
| A、CaC2能水解:CaC2+2H2O═Ca(OH)2+C2H2↑,则Al4C3也能水解:Al4C3+12H2O═4Al(OH)3↓+3CH4↑ |
| B、O2与Cu加热反应生成CuO,则S与Cu加热反应生成CuS |
| C、根据化合价Fe3O4可表示为FeO?Fe2O3,则Fe3I8也可表示为FeI2?2FeI3 |
| D、SO2通入BaCl2溶液中不产生沉淀,则SO2通入Ba(NO3)2溶液中也不产生沉淀 |


科目:高中化学 来源: 题型:
| A、6个碳原子有可能都在同一直线上 |
| B、在同一直线上的原子至少有5个 |
| C、在同一平面上的原子至少有8个 |
| D、分子中呈四面体结构的碳原子有3个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 | 结论 | |
| A | 加入浓NaOH溶液,加热 | 湿润的红色石蕊试纸变蓝 | 原溶液中一定含有NH4+ |
| B | 加入稀盐酸,将产生的气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中一定含有CO32- |
| C | 加入少量双氧水,再加几滴KSCN溶液 | 溶液变红 | 原溶液中一定含有Fe2+ |
| D | 加入BaCl2溶液,再加入稀硝酸 | 有白色沉淀生成 | 原溶液中一定含有SO42- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、分子式为:C17H18O6 |
| B、1mol霉酚酸最多与5molH2发生加成反应 |
| C、不能与FeCl3溶液发生显色反应 |
| D、一定条件下 1 mol霉酚酸最多可与3 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、三聚氰胺是劣质蛋白质 |
| B、在检测条件下三聚氰胺可以转化为蛋白质 |
| C、三聚氰胺中氮元素的含量高于蛋白质中氮的含量 |
| D、三聚氰胺及蛋白质中的氮元素在检测条件下可以转化生成相同的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?
某研究性学习小组欲探究“在加热条件下FeSO4的分解产物”?| 操作步骤 | 预期实验现象 | 预期实验结论 |
| 向其中一份溶液中加入 |
固体中含有Fe2O3 | |
| 向另一份溶液中滴加2滴黄色K3[Fe(CN)6]溶液? | 产生蓝色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
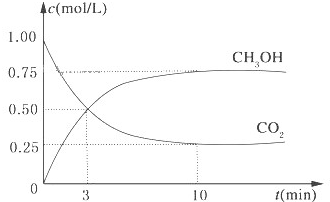 降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.
降低大气中CO2的含量及有效地开发利用 CO2,目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.测得CO2和CH3OH(g)的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com