
【题目】已知:A、B为单质,C为淡黄色固体,A、B、C、D、E、F有如下转化关系
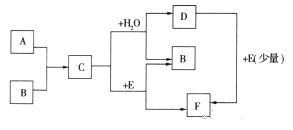
(1)写出A、B、E的化学式:
A_________________,B_________________,E___________________。
(2)完成下列化学反应方程式:
①C+H2O:__________________________________。
②D+E:_____________________________________。
【答案】 Na O2 CO2 2Na2O2+2H2O=4NaOH+O2↑ 2NaOH+CO2=Na2CO3+ H2O
【解析】A、B为单质,C为淡黄色固体,C能与水反应生成单质B与D,则C是Na2O2,可推知B为O2,A为Na、D为NaOH,过氧化钠与E反应生成氧气与F,则E为CO2、F为Na2CO3,氢氧化钠与少量的二氧化碳反应可以得到碳酸钠。
(1)由上述分析可知,A为Na,B为O2,E为CO2,故答案为:Na;O2;CO2;
(2)①C+H2O的反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,故答案为:2Na2O2+2H2O=4NaOH+O2↑;
②D+E(少量)的反应方程式为:2NaOH+CO2=Na2CO3+H2O,故答案为:2NaOH+CO2=Na2CO3+H2O。


科目:高中化学 来源: 题型:
【题目】下列关于蛋白质的叙述中,不正确的是( )
A.蚕丝、羊毛、病毒等主要成分都是蛋白质
B.蛋白质溶液中加入饱和硫酸铵溶液,蛋白质析出,再加水,也不溶解
C.重金属盐能使蛋白质凝结
D.浓硝酸使皮肤呈黄色是由于浓硝酸与蛋白质发生了颜色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图提供的信息,下列所得结论正确的是( ) 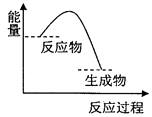
A.该反应过程中,形成新化学键释放的总能量小于断裂旧化学键吸收的总能量
B.因为生成物的总能量低于反应物的总能量,所以该反应不需要加热即可进行
C.该图象可以表示碳酸钙受热分解的能量变化
D.该图象可以表示锌与稀硫酸反应的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大.m、p、q、r、s是由这些元素组成的二元化合物,常温常压下r为液体,其余均为无色气体,m的摩尔质量为p的2倍,n是元素Y的单质,是绿色植物光合作用产生的无色气体,p能使湿润的红色石蕊试纸变蓝,q能使品红溶液褪色.上述物质之间的转化关系如图所示.下列说法正确的是( ) 
A.原子半径:X<Y<Z
B.非金属性:X>Y>Z
C.W、X、Y、Z四种元素可形成离子化合物
D.q与s均为酸性氧化物,m的水溶液显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是_____________________。
(2)在后4 min内用HCl表示的平均反应速率是______________________。
(3)前2 min与后4 min相比,反应速率较快的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中乙醇分子断裂的仅是碳氧键的是( )
A.乙醇与金属钠反应产生氢气
B.乙醇在浓硫酸140℃条件下反应
C.乙醇与氢卤酸发生取代反应生成卤代烃
D.乙醇在酸性重铬酸钾的氧化下生成乙醛或乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃,将2 mol X和1 mol Y充入体积为1L的密闭容器中,已知:2X(g)+Y(g) ![]() 2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
2Z(s)△H=-M kJ·mol-1。10 min后达到平衡,生成0.2 mol Z,共放出热量N kJ,下列说法正确的是 ( )
A. 在10 min时,X的反应速率为0.02 mol·L-1·min-l
B. 在0~10 min内,Y的反应速率为![]() mol·L-1·min-l
mol·L-1·min-l
C. 无法计算该温度下Y的平衡转化率
D. 反应达平衡后,保持T℃,通入稀有气体增加压强,则化学反应速率变快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于氨的合成工业的下列说法正确的是( )
A.从合成塔出来的气体,其中氨气一般占15%,所以生产氨的工业的效率都很低
B.由于NH3易液化,N2、H2可循环使用,则总的说来氨的产率很高
C.合成氨工业的反应温度控制在400~500 ℃左右,目的是使平衡向正反应方向进行
D.合成氨工业采用10 MPa~30 MPa,是因该条件下催化剂的活性最好
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了进一步提高合成氨的生产效率,科研中具有开发价值的是( )
A.研制高温下活性较大的催化剂
B.寻求NH3的新来源
C.研制低温下活性较大的催化剂
D.研制耐高温高压的新型材料建造合成塔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com