
(1)自来水厂可以用氯气来杀菌、消毒,则氯气与水反应的离子方程式为:______________,此反应中氧化产物是______________。
(2)老师在课堂上演示了一个趣味实验:把一块湿润的有色布条放到盛有干燥氯气的集气瓶中。有色布条很快变成“白色”布条。学生对此进行了猜测。
猜测一:氯气具有漂白性,能使有色布条褪色
猜测二:氯气与湿润有色布条上的水分作用,产生的次氯酸使有色布条褪色。
某同学设计如下实验装置,验证猜想是否正确:

I. 将预期的实验现象和结论填在下表中。
| 步骤 | 实验操作 | 预期现象和结论 |
| ① | 松开a处弹簧夹, b处弹簧夹 | 装置左边集气瓶中的有色布条 ,证明猜想一不正确。 |
| ② | 松开 | 装置右边集气瓶中的有色布条褪色, 说明猜想二 。 |
Ⅱ.该装置左右两边均设计了盛有氢氧化钠溶液的吸收装置,作用是 。
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
某溶液中可能含有以下6种离子中的几种:NH4+、A13+、Mg2+、CO32—、Cl一、SO42—,为确认溶液组成,现取100 mL分成三等份。溶液进行如下实验:
⑴向第一份溶液中加入 AgNO3溶液有沉淀产生;
⑵向第二份溶液中加入足量NaOH溶液充分反应后,最终得到沉淀0.58 g(经过滤、洗涤、干燥,下同),同时收集到气体0.03 mol(设气体全部从溶液中逸出);
⑶向第三份溶液中加入足量BaCl2溶液(盐酸酸化)充分反应后,得到沉淀6.99 g。
由此可知,下列关于原溶液组 成的正确结论是
成的正确结论是
A.一定存在Cl一  B.一定存在A13+和NH4+
B.一定存在A13+和NH4+
C.一定不存在Mg2+,可能存在A13+ D.溶液中SO42—的浓度是0. 3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,不正确的是( )
A.NH3的水溶液可以导电,说明NH3是电解质
B.明矾水解形成Al(OH)3胶体有吸附性,可用于水的净化
C.二氧化硅可用于制造光导纤维
D.向淀粉碘化钾溶液中加溴水,溶液变为蓝色,说明Br2的氧化性强于I2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是
A.硫化氢的电子式为:
B.石英、水晶、玛瑙的主要成分都是二氧化硅
C.实验室用稀硝酸与锌单质制备氢气
D.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计如图装置来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物。下列说法正确的是
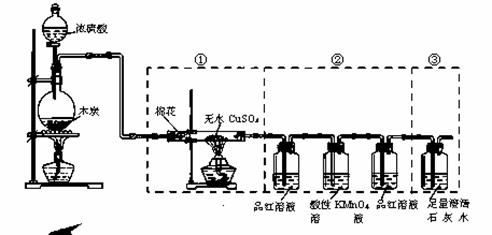
A. 实验时可观察到装置①中白色硫酸铜粉末变蓝色
B. 装置②中两次用到品红溶液的作用相同
C. 装置③用于检验产物中二氧化碳气体的生成
D. 如果将仪器的连接顺序变为②③①,同样可以检出所有气体产物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关元素的性质及其递变规律正确的是
A.IA族与VIIA族元素间可形成共价化合物或离子化合物
B.短周期的元素从左到右,其最高正价均从+1递增到+7
C.同主族元素的简单阴离子还原性越强,水解程度越大
D.同周期金属元素的化合价越高,其原子失电子能力越强
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH  CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
实验步骤如下:
①将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸;②将所得溶液小心转移至B中;③在A中加入4.0g正丁醇和几粒沸石,加热;④当有蒸汽出现时,开始滴加B中溶液;⑤滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分;⑥将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.16g。
回答下列问题:
(1)实验装置中,_______(填图中的字母)处应与自来水龙头连接。
(2)该实验除了必要的仪器和试剂外还不可缺少的用品是________________。
(3)上述装置图中,C2仪器的名称是__________________,E仪器的名称是______________。
(4)进行实验前必须进行的操作是____________。
(5)将正丁醛粗产品置于分液漏斗中分水时,正丁醛应从_________(填正确答案标号)。
a. 下口放出 b. 上口倒出
(6)反应温度应保持在90—95℃,其原因是为了将正丁醛及时分离出来,促使反应正向进行和减少正丁醛的进一步氧化,该氧化反应的方程式是__________________________。
(7)本实验中,正丁醛的产率为_____________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数,下列说法正确的是
A.0.2 mol H2O2完全分解转移的电子数为0.4 NA
B.300 mL 2 mol/L蔗糖溶液中所含分子数为0.6 NA
C.在标准状况下,2.8 g N2和2.8 g CO所含电子数均为1.4 NA
D.在常温常压下,2.24 L SO2与O2混合气体中所含氧原子数为0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
铜及其化合物在生产、生活中有广泛的应用。
Ⅰ、铜可采用如下方法制备:
方法一:火法炼铜:Cu2S + O2  2Cu + SO2
2Cu + SO2
方法二:湿法炼铜: CuSO4 + Fe  FeSO4 + Cu
FeSO4 + Cu
上述两种方法中,你认为哪种方法更好 ,原因是 (写出1条原因即可)。分别用火法炼铜与湿法炼铜生产640gCu,则转移的电子数之比为 。
Ⅱ、印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O晶体,实验室模拟回收过程如下:

①步骤2中反应的离子方程式是 。
②步骤5中蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O晶体。
③步骤4中洗涤沉淀的操作为
④步骤3中可选用的“试剂1”是 (写出一种即可),目的是使溶液的pH升高到4,此时Fe3+浓度为 [Ksp(Fe(OH)3)=4×10-38]。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com