
【题目】实验室用高锰酸钾制氧气的产物之一是锰酸钾。锰酸钾(K2MnO4)中锰元素的化合价是
A.+7 B.+6 C.+5 D.+4
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下图所示的四个容器中分别盛有不同的溶液,除a、b外,其余电极均为石墨电极。甲为铅蓄电池,其工作原理为:Pb + PbO2+2H2SO4![]() 2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同:据此回答:
2PbSO4+2H2O,其两个电极的电极材料分别为PbO2和Pb。闭合K,发现g电极附近的溶液先变红,20min后,将K断开,此时c、d两极上产生的气体体积相同:据此回答:
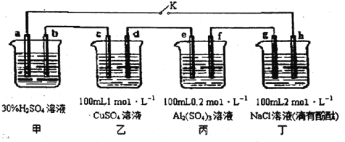
(1) a电极的电极材料是____________________ (填“PbO2”或“Pb”)。
(2)丙装置中发生电解的总反应方程式为_____________________。
(3)电解20min时,停止电解,此时要使乙中溶液恢复到原来的状态,需要加入的物质及其物质的量是________________。
(4)20min后将乙装置与其他装置断开,然后在c、d两极间连接上灵敏电流计,发现电流计指针偏转,则此时c电极为_______极,d电极上发生反应的电极反应式为_____________。
(5)电解后取amL丁装置中的溶液,向其中逐滴加入等物质的量浓度的CH3COOH溶液,当加入 bmLCH3COOH溶液时,混合溶液的pH恰好等于7(体积变化忽略不计)。己知CH3COOH 的电离平衡常数为1.75×10-5,则a/b=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的转化,不能通过一步反应完成的是( )
A.Na2CO3→Na2SiO3
B.SiO2→H2SiO3
C.Cu→CuSO4
D.SiO2→Si
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.同温同压下,相同体积的物质,它们的物质的量必相等
B.任何条件下,等物质的量的二氧化碳和一氧化碳所含的分子数必相等
C.1 L一氧化碳气体一定比1 L氧气的质量小
D.等体积、等物质的量浓度的强酸中所含的H+数一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
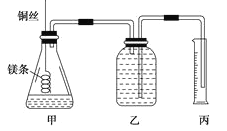
② 配制100mL.1.0mol·L-1的盐酸溶液;
②用__________(填仪器名称并注明规格)量取10.0mL 1.0mol·L-1的盐酸溶液加入锥形瓶甲中;
③称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为__________g;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。
请将上述步骤补充完整并回答下列问题。
(1)步骤①中,配制100mL 1.0mol·L-1的盐酸溶液时,下列哪些操作会使配制浓度偏小________(填写字母)。
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液
C.浓盐酸在烧杯中稀释时,搅拌时间过长
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
(2)请填写操作步骤中的空格:步骤②_________,步骤③_________g。
(3)实验步骤⑤中应选用____________(填字母)的量筒;
A.100mL B.200mL C.500mL
读数时除恢复到室温,调节乙丙内液面相平外,还要注意 。
(4)忽略水蒸气影响,在该条件下测得气体摩尔体积的计算式为Vm=____________L/mol。
(5)若未除去镁条表面的氧化镁,则测得该条件下气体的摩尔体积 (填偏大、偏小或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5gHCl气体溶解在1L水中(水的密度近似为1g/cm3),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A.所得溶液的物质的量浓度为1mol/L
B.所得溶液中含有NA个HCl分子
C.36.5gHCl气体占有的体积为22.4L
D.所得溶液的质量分数:ω=36.5c/(1000ρ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含58.2%的SiO2、21.0%的ZnO、4.50%的ZnS和12.8%的CuS。某同学用15.0 g该废催化剂为原料,回收其中的锌和铜。采用的实验方案如下:
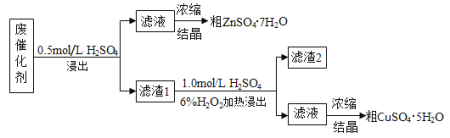
已知:ZnS与稀硫酸反应,且化合价不变;CuS不与稀硫酸反应。回答下列问题:
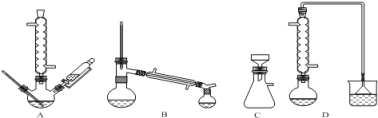
(1)在下列装置中,第一次浸出必须用 。(填标号)
(2)第二次浸出时,向盛有滤渣1的反应器中先加入稀H2SO4,后滴入H2O2溶液。
①写出第二次浸出(有单质生成)的化学方程式 。
②若滴加H2SO4和H2O2顺序相反,会造成 。
③滤渣2的主要成分是 。
CuS+H2O2+H2SO4=CuSO4+S+2H2O
(3)浓缩硫酸锌、硫酸铜溶液使用的主要仪器名称是 。
(4)该同学在实验完成之后,得到1.50g CuSO4·5H2O,则铜的回收率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列气体的检验方法中,正确的是
A. 用澄清石灰水鉴别SO2 和CO2 B. 用酸性高锰酸钾溶液鉴别乙烯和乙炔
C. 用湿润的淀粉-KI 试纸检验 Cl2 D. 用湿润的蓝色石蕊试纸检验氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在19世纪后期,人们发现炼铁高炉所排出的高炉气中含有相当量的CO,于是英国耗巨资把烟囱建高,根据所学知识回答问题。
化学反应限度的调控在工业生产和环保技术等方面得到了广泛的应用,如果设法提高化学反应的限度,下面说法错误的是( )
A.能够节约原料和能源
B.能提高产品的产量
C.能够提高化学反应速率
D.能够提高经济效益
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com