
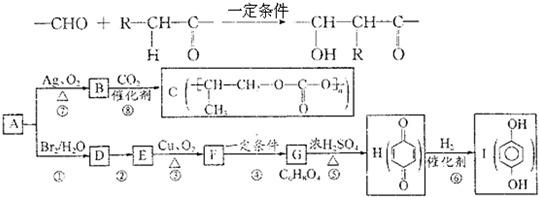
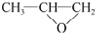
 ,A氧化得B,所以可知A为CH3CH=CH2,根据题中各物质的转化关系,可知D为CH3CHBrCH2Br,由F→G的反应条件和题中信息,结合E→F是在铜做催化剂的条件下的氧化,可推得E为CH3CHOHCH2OH,所以F为CH3COCHO,G为
,A氧化得B,所以可知A为CH3CH=CH2,根据题中各物质的转化关系,可知D为CH3CHBrCH2Br,由F→G的反应条件和题中信息,结合E→F是在铜做催化剂的条件下的氧化,可推得E为CH3CHOHCH2OH,所以F为CH3COCHO,G为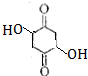 ,D在碱性条件下水解得E,G在浓硫酸条件下加热发生消去反应生成H,据此答题;
,D在碱性条件下水解得E,G在浓硫酸条件下加热发生消去反应生成H,据此答题; ,A氧化得B,所以可知A为CH3CH=CH2,根据题中各物质的转化关系,可知D为CH3CHBrCH2Br,由F→G的反应条件和题中信息,结合E→F是在铜做催化剂的条件下的氧化,可推得E为CH3CHOHCH2OH,所以F为CH3COCHO,G为
,A氧化得B,所以可知A为CH3CH=CH2,根据题中各物质的转化关系,可知D为CH3CHBrCH2Br,由F→G的反应条件和题中信息,结合E→F是在铜做催化剂的条件下的氧化,可推得E为CH3CHOHCH2OH,所以F为CH3COCHO,G为 ,D在碱性条件下水解得E,G在浓硫酸条件下加热发生消去反应生成H,
,D在碱性条件下水解得E,G在浓硫酸条件下加热发生消去反应生成H, ;⑤的反应类型是消去反应,
;⑤的反应类型是消去反应, ;消去反应;
;消去反应; ,
, ;
; ,
, ;
; ,满足下列条件:①属于酯②核磁共振氢谱只有两种吸收峰③无环④不能发生银镜反应,说明没有醛基,符合这些条件的G的同分异构体有
,满足下列条件:①属于酯②核磁共振氢谱只有两种吸收峰③无环④不能发生银镜反应,说明没有醛基,符合这些条件的G的同分异构体有 ,
, ;
;


科目:高中化学 来源: 题型:
| A、同温同压下,28g的CO与N2组成的混合气体中含有原子数一定为2NA |
| B、0.1mol?L-1的稀硫酸中含有SO42-个数为0.1NA |
| C、56克铁在氯气中完全燃烧,共转移3NA个电子 |
| D、1L 1mol/L 的盐酸中含有NA个HCl分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | CH3COOH溶液的体积/mL | NaOH溶液的体积/mL | 结论 |
| ① | 0 | 20.00 | NaOH溶液pH=13 |
| ② | x | 20.00 | 反应后溶液呈碱性 |
| ③ | y | 20.00 | 反应后溶液呈中性 |
| A、NaOH溶液的浓度等于0.01mol.L-1 |
| B、CH3COOH溶液的浓度可能等于2/x mol.L-1 |
| C、CH3COOH溶液的浓度等于2/y mol.L-1 |
| D、②组反应后混合液中,离子浓度相对大小关系为:c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、78g Na2O2与足量水充分反应时电子转移数为NA |
| B、25℃、101.3kPa时,11.2LH2中含有的原子数为NA |
| C、标况下,22.4LH2O 中含有的原子数为3NA |
| D、2L 1mol/L Na2SO4 溶液中离子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某酸式盐NaHY 的水溶液显碱性,则H2Y的电离力程式为H2Y=H++HY- |
| B、Na2CO3 溶液中存在:c(Na+)=2c(CO32-)+2 c(HCO3-)+2c(H2CO3 ) |
| C、在由水电离出的C(H+)=1×10-14mol?L-1的溶液中,可以大量存在Na+、K+、NO3-、HCO3- |
| D、在常温下,向10mLpH=12 的氢氧化钠溶液中加入pH=2 的HA 溶液至pH 刚好等于7,所得洛液体积v (总)≤20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
| Br2 |
| Cu/O2 |
| △ |

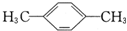 的系统命名为
的系统命名为
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com