
【题目】甲醇(CH3OH)是一种优质燃料,
(1)已知一定条件下88gCO2和足量氢气完全反应三可生成气态甲醇(CH3OH)和水蒸汽并放出98kJ的热量.请回答: ①该反应的热化学方程式: .
②若生成3mol甲醇放出的热量为 .
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1molCO2和3molH2 , 一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图. 
请回答:
①从反应开始到平衡,氢气的反应速率:v(H2)= .
②下列措施中能使CO2反应速率增大的是 .
A.加入催化剂 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.升高温度
③能够说明该反应已达到平衡的是 .
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度不再变化
D.一定条件下,单位时间内消耗3molH2的同时生成1molCH3OH.
E.有2个C=O键断裂的同时,有3个H﹣H键断裂.
【答案】
(1)CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;147kJ
(2)0.225mol?L﹣1?min﹣1;AD;AC
【解析】解:(1)①88gCO2的物质的量为n= ![]() =
= ![]() =2mol,放出98kJ的热量,每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;②每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,若生成3mol甲醇放出的热量为49kJ×3=147kJ,故答案为:147kJ;(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则①依据化学平衡列式计算为:
=2mol,放出98kJ的热量,每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,热化学方程式为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,故答案为:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol;②每1molCO2和足量氢气完全反应三可生成1mol气态甲醇(CH3OH)和1mol 水蒸汽并放出49kJ的热量,若生成3mol甲醇放出的热量为49kJ×3=147kJ,故答案为:147kJ;(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;则①依据化学平衡列式计算为:
CO2(g)+ | 3H2(g) | CH3OH(g)+ | H2O(g) | ||
起始量(mol/L) | 1 | 3 | 0 | 0 | |
变化量(mol/L) | 0.75 | 2.25 | 0.75 | 0.75 | |
平衡量(mol/L) | 0.25 | 0.75 | 0.75 | 0.75 |
H2的平均反应速率v(H2)= ![]() =
= ![]() =0.225molL﹣1min﹣1 ,
=0.225molL﹣1min﹣1 ,
故答案为:0.225molL﹣1min﹣1 ;②A.加入催化剂,v (CO2)增大,故A正确;
B.充入He(g),使体系压强增大,但反应物浓度不变,所以v (CO2)不变,故B错误;C.将H2O(g)从体系中分离,则生成物浓度减小,则浓度减小,故C错误;D.升高温度,v (CO2)增大,故D正确;故答案为:AD;③A.反应前后气体的体积不等,所以压强一直在变,则当压强不变时能说明达到平衡,故A正确;B.反应前后质量不变,体积也不变,所以密度一直不变,则混合气体的密度不再变化不能说明达到平衡,故B错误;C.CO2、H2和CH3OH的浓度不再变化,说明达到平衡,故C正确;D.单位时间内消耗3molH2的同时生成1molCH3OH,都是指正反应方向,不能说明达到平衡,故D错误;E.CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol,CO2结构简式为O=C=O,1个分子有2个C=O键,当2个C=O键断裂的同时,必有3个H﹣H键断裂,与是否已达到平衡无关,故E错误;故答案为:AC.
(1)①根据n= ![]() 计算88gCO2和氢气化合生成甲醇和水放出的热量,结合热化学方程式书写方法标注物质聚集状态和反应焓变写出;②反应热与化学计量数成正比,根据热化学方程式计算;(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;①依据化学平衡三段式列式利用V=
计算88gCO2和氢气化合生成甲醇和水放出的热量,结合热化学方程式书写方法标注物质聚集状态和反应焓变写出;②反应热与化学计量数成正比,根据热化学方程式计算;(2)在体积为l L的密闭容器中,充入l mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如图2所示.二氧化碳是反应物随反应进行浓度减小,甲醇是生成物,随反应进行浓度增大;10nim内达到平衡,生成甲醇浓度为0.75mol/L,二氧化碳浓度变化了0.75mol/L;①依据化学平衡三段式列式利用V= ![]() 计算;②依据升温,增加浓度,加压,加催化剂等可以加快反应速率判断;③可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析解答.
计算;②依据升温,增加浓度,加压,加催化剂等可以加快反应速率判断;③可逆反应达到平衡状态时,正逆反应速率相等(同种物质)或正逆反应速率之比等于系数之比(不同物质),平衡时各种物质的量、浓度等不再发生变化,由此衍生的一些物理量不变,以此分析解答.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质性质与用途具有对应关系的是( )
A. Al2O3熔点高,可用作耐高温材料
B. SO2具有氧化性,可用于漂白纸浆
C. SiO2硬度大,可用于制造光导纤维
D. NH3易溶于水,可用作制冷剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
(1)X与Y所形成化合物晶体的晶胞如图所示.在1个晶胞中,X离子的数目为 .
(2)在Y的氢化物(H2Y)分子中,Y原子轨道的杂化类型是 .
(3)Z的氢化物(H2Z)在乙醇中的溶解度大于H2Y,其原因是 .
(4)Y与Z可形成YZ42﹣ , YZ42﹣的空间构型为(用文字描述);写出一种与YZ42﹣互为等电子体的分子的化学式: . 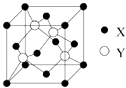
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有下列键型的物质,可能为单质的是
A. 只有离子键的物质 B. 既有离子键,又有非极性键的物质
C. 既有极性键,又有离子键的物质 D. 只有非极性键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.氯碱工业中电解饱和食盐水:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣
H2↑+Cl2↑+2OH﹣
B.氯化铁溶液腐蚀铜板:Fe3++Cu=Fe2++Cu2+
C.氢氧化钠溶液吸收少量二氧化硫SO2+OH﹣=HSO3﹣
D.稀硫酸中加氢氧化钡溶液至中性:Ba2++H++OH﹣+SO42﹣=BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2、O2、N2 3种气体分别放在三个不同的密闭容器中,当它们的温度、密度完全相同时,这3种气体的压强(P)大小关系正确的是
A. P(H2)=P(O2)=P(N2) B. P(O2)> P(N2)> P(H2)
C. P(H2)> P(N2) > P(O2) D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2O(g)=H2O(l)△H=﹣44kJ/mol,所以该过程是放热反应
B.人类利用的能源都是通过化学反应获得的
C.2CO(g)+O2 ![]() 2CO2(g)△H<0,则56gCO和32gO2所具有的总能里大于88g所具有的总能量
2CO2(g)△H<0,则56gCO和32gO2所具有的总能里大于88g所具有的总能量
D.需要加热的反应一定是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用广泛pH试纸测得某溶液的pH为0
B.检验某溶液含有NH4+:取试样少许于试管中,加入足量NaOH溶液加热,用湿润红色石蕊试纸检验变蓝
C.液溴保存时液面覆盖一层水,装在带橡胶塞的细口试剂瓶中
D.配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就定容,所配制的溶液浓度偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2、SO2均能使品红溶液褪色.后者因为品红分子结构中的发色团遇到亚硫酸后结构发生改变,生成不稳定的无色化合物.其漂白原理可用下面的反应方程式表示: 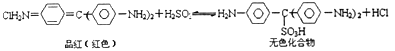
下列说法正确的是( )
A.品红溶液中同时通入Cl2、SO2 , 漂白效果会更好
B.加热可判断品红褪色是通入SO2还是通入Cl2引起的
C.“无色化合物”分子中,19个碳原子都可能在同一平面上
D.无色化合物中的官能团有苯环、磺酸基、氨基
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com