
【题目】在T℃时,发生反应C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)恒温时,在一个2L的密闭容器中加入4molC 和1molH2O(g),5min后反应达到平衡,C 的转化率为20%。
①0~5min 内,用H2O(g)表示的平均反应速率为_________。
②有关该反应下列说法正确的是_________。
a.容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态
b.若将加入的碳块改为碳粉,则能够提高水蒸气的平衡转化率
c.平衡后,再加入0 .5molC、5mol H2O(g)、2molCO、2molH2,平衡不移动
(2)已知:Ⅰ.破坏1mol 共价键所需要的能量如下表:
共价键 | 石墨中的碳碳键 | H-H | C | H-O |
能量/kJ | 475.7 | 436 | 1072 | 463 |
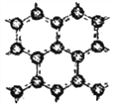
Ⅱ.石墨层由六角形蜂巢结构的碳原子构成,如右图所示,已知每个碳原子形成的共价键数为1.5NA。
某同学构想:通过下图所示装置实现C(s)+H2O(g)![]() CO(g)+H2(g)的反应。
CO(g)+H2(g)的反应。
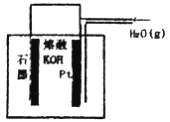
①按该考生的构想,石墨电极发生的反应式为_______________________。
②请用计算判断该构想的合理性:______________________。
【答案】 0.08mol/(L·min) a C-2e-+2OH-=CO↑+H2O 该反应的焓变为: △H=1.5×475.7kJ+2×463 kJ-1072kJ-436kJ=+131.5kJ>0,说明是吸热反应,不能将化学能转化为电能,因此该构想不合理
【解析】(1) C(s)+H2O(g)![]() CO(g)+H2(g)
CO(g)+H2(g)
起始(mol)4 1 0 0
反应(mol)0.8 0.8 0.8 0.8
平衡(mol) 0.2 0.8 0.8
①5min后反应达到平衡,C的转化率为20%,反应的C为4mol×20%=0.8mol,则反应的H2O为0.8mol,v(H2O)= 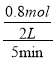 = 0.08mol/(L·min),故答案为:0.08mol/(L·min);
= 0.08mol/(L·min),故答案为:0.08mol/(L·min);
②a.该反应为气体的物质的量变化的反应,气体的质量也发生变化,容器中压强不变或混合气体密度不变均可以判定该反应已经达到平衡状态,故a正确;b.若将加入的碳块改为碳粉,能够加快反应速率,但不会改变平衡,水蒸气的平衡转化率不变,故b错误;c.平衡常数K=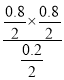 =1.6,Qc=
=1.6,Qc=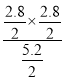 <K=1.6,平衡一定发生移动,故c错误;故选a;
<K=1.6,平衡一定发生移动,故c错误;故选a;
(2)①根据图示,反应的总反应为C(s)+H2O(g)![]() CO(g)+H2(g),则石墨电极为负极,发生氧化反应,反应式为C-2e-+2OH-=CO↑+H2O,故答案为:C-2e-+2OH-=CO↑+H2O;
CO(g)+H2(g),则石墨电极为负极,发生氧化反应,反应式为C-2e-+2OH-=CO↑+H2O,故答案为:C-2e-+2OH-=CO↑+H2O;
②根据表格数据,该反应的焓变为:△H=1.5×475.7kJ+2×463kJ-1072kJ-436kJ=+131.5kJ>0,说明是吸热反应,不能将化学能转化为电能,因此该构想不合理,故答案为:该反应的焓变为:△H=1.5×475.7kJ+2×463kJ-1072kJ-436kJ=+131.5kJ>0,说明是吸热反应,不能将化学能转化为电能,因此该构想不合理。


科目:高中化学 来源: 题型:
【题目】用双线桥法标出下列反应中电子转移的方向和数目:_____________。
MnO2 + 4HCl(浓) ![]() MnCl2 + Cl2↑+ 2H2O
MnCl2 + Cl2↑+ 2H2O
此反应中,还原剂是 _______,氧化剂是 ________;_____元素被氧化,__元素被还原。由此可知,氧化还原反应的实质是__________________________________________。根据你的理解再写一个常见的氧化还原反应的化学方程式: _______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是
A. 常温常压下,20g氖气所含有的原子数目为0.5NA
B. 2.8铁粉与50mL4 mol·L-1盐酸完全反应转移电子的数目为0.1NA
C. 标准状况下,22.4 LSO2和SO3混合物中含有的硫原子数目为0.1NA
D. 28g的C2H4和N2混合气体中含有的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气。某校研究性学习小组拟设计下列实验验证这一事实。

(1)该小组设计了如上图所示的实验装置,检查该装置气密性的操作是______________________。
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重0.64g(烧瓶中残留气体忽略不计,下同),则圆底烧瓶中发生反应的化学方程式为________________________________。
(3)是否使用橡胶管,对实验结果___________(填“有”或“无”) 影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁的快速发展方便了人们的出行。工业上利用铝热反应焊接钢轨间的缝隙。反应的方程式如下:2Al+Fe2O3![]() 2Fe+Al2O3,下列说法不正确的是( )
2Fe+Al2O3,下列说法不正确的是( )
A. 氧化剂是Fe2O3,氧化产物是 Al2O3。
B. 被氧化的元素是铝,被还原的元素是铁。
C. 当转移的电子为0.3mol时,参加反应的铝为2.7g
D. Fe2O3既不是氧化剂又不是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列有关叙述正确的是( )
A. 24g镁在足量的O2中燃烧,转移的电子数为0.1NA
B. 分子总数为NA的NO2和CO2混合气体中含有的氧原子數为2NA
C. 1L一氧化碳气体一定比1L氧气的质量小
D. 常温常压下8gO3中含有8NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置完成对应的实验,能达到实验目的的是
实验装置 |
|
|
|
|
实验目的 | 实验验证浓硫酸具有脱水性、氧化性 | 制取并收集少量氨气 | 验证NaHCO3和Na2CO3的热稳定性 | 采用CCl4萃取I2 |
A | B | C | D |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d四个集气瓶中装有Cl2、H2、HCl、HBr中的任一种气体,若a、d两瓶气体混合后强光照射下发生爆炸,a、b两瓶气体相混,瓶壁上出现红棕色液滴,则a、b、c、d四瓶中气体应是( )
A.Cl2、HBr、HCl、H2
B.Cl2、HCl、HBr、H2
C.H2、HBr、HCl、Cl2
D.H2、HCl、HBr、Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 2g D218O中所含中子数为NA
B. 2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA
C. 1mol/L碳酸氢钠溶液中的HCO3—数目小于NA
D. 一定条件下,39g的乙炔和苯的气体混合物中所含原子总数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com