

| A. | 电导率传感器能用于判断酸碱中和滴定的终点 | |
| B. | 该过程中,a点所示溶液的导电性最强 | |
| C. | c点电导率最小是因为此时溶液中导电微粒数目最少 | |
| D. | d点所示溶液中存在:c(Cl-)+c(OH-)=c(H+)+c(Na+) |
分析 A.根据图知,溶液电导率与离子浓度成正比,当V(NaOH)=10mL时,酸碱恰好完全反应生成NaCl,离子浓度最小,其电导率最小;
B.离子浓度与电导率成正比、溶液导电性成正比;
C.离子浓度与电导率成正比,则离子浓度越小,其电导率越低;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒判断.
解答 解:A.根据图知,溶液电导率与离子浓度成正比,当V(NaOH)=10mL时,酸碱恰好完全反应生成NaCl,离子浓度最小,其电导率最小,所以可以根据电导率确定酸碱中和终点,故A错误;
B.离子浓度与电导率成正比、溶液导电性成正比,离子浓度越大其电导率越高,根据图知,a点溶液电导率高,说明a溶液中离子浓度大,其导电性强,故B正确;
C.离子浓度与电导率成正比,则离子浓度越小,其电导率越低,c点溶液电导率最小,说明该点溶液中离子浓度最小,与导电粒子数目无关,故C错误;
D.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(Cl-)+c(OH-)=c(H+)+c(Na+),故D正确;
故选AC.
点评 本题考查图象分析,为高频考点,侧重考查学生分析判断及理解运用能力,明确电导率影响因素、溶液中溶质成分及其浓度是解本题关键,易错选项是C,注意:溶液导电性与离子浓度成正比,与溶液酸碱性及离子总数无关.


科目:高中化学 来源: 题型:多选题
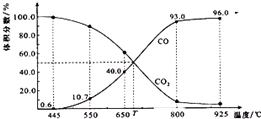 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:已知:气体分压(p分)=气体总压(p总)×体积分数.下列说法正确的是( )| A. | 550℃时,若充入惰性气体,v正、v逆 均减小,平衡不移动 | |
| B. | 650℃时,反应达平衡后CO2的转化率为25.0% | |
| C. | T℃时,若充入等体积的CO2和CO,平衡不移动 | |
| D. | 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=24.p总 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯 | |
| B. | 苯不能使酸性高锰酸钾褪色,说明苯环中没有碳碳双键 | |
| C. | 甲烷中混有的乙烯可以用溴的四氯化碳溶液除去 | |
| D. | 医院用75%酒精杀菌、消毒,75%是指质量分数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 由图1的一级电离与二级电离的Ka值可知H2SO3?2H++SO32- Ka≈10-7 | |
| B. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中H2S、HS-、HSO3-、SO32-可同时一定量共存 | |
| C. | 向1L0.1 mol•L-1的Na2S溶液中持续通入SO2气体达到0.1 mol时,溶液中存在如下关系:c(H+)+c(Na+)═c(OH-)+2c(S2-)+2c(SO32-)+c(HS- )+c(HSO3-) | |
| D. | 在反应过程中当pH降至7.5左右,之后可能出现淡黄色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
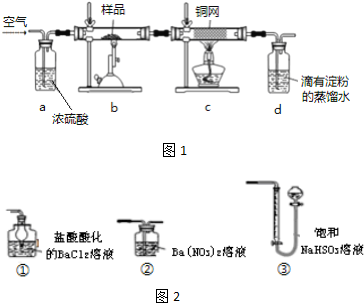
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 产品标准 | GB5461 |
| 产品等级 | 一级 |
| 配 料 | 食盐、碘酸钾、抗结剂 |
| 碘含量(以I计) | 20~50mg/kg |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com