
| m |
| V |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
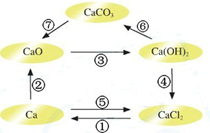 电解熔融氯化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按如图箭头所表示的物质间可能发生的转化,分析下列说法中正确的是( )
电解熔融氯化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙.请你根据已学知识,按如图箭头所表示的物质间可能发生的转化,分析下列说法中正确的是( )| A、CaO、Ca(OH)2、CaCO3都含有氧元素,所以CaO、Ca(OH)2、CaCO3都属于氧化物 |
| B、电解熔融氯化钙得到金属钙和氯气的反应既是氧化还原反应又是化合反应 |
| C、虽然碳酸钙的水溶液不导电,但碳酸钙是电解质 |
| D、工业上以氯气和石灰水为原料通过反应④生产漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 溶液中无K+ |
| B | 向溶液中先滴加稀盐酸,再滴加BaCl2溶液 | 先滴加稀盐酸无现象,滴加BaCl2后出现白色沉淀 | 溶液中一定含有SO42- |
| C | 向一定浓度的CuSO4溶液中通入适量H2S气体 | 出现黑色沉淀 | H2S的酸性比H2SO4强 |
| D | 向某溶液中滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| A、A |
| B、B |
| C、C |
| D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.8mol?L-1 |
| B、3.2mol?L-1 |
| C、3.6mol?L-1 |
| D、无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:
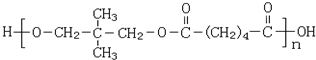

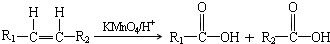
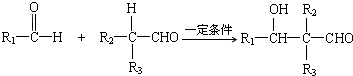
查看答案和解析>>
科目:高中化学 来源: 题型:
| 资料卡片 | ||
| 物质 | 熔点 | 沸点 |
| SiCl4 | -70℃ | 57.6℃ |
| TiCl4 | -25℃ | 136.5℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com