
���б�����ȷ���Ǣٿ���ʹ�����������Դ�����ٻ�ʯȼ�ϵ�ȼ�գ��ɴӸ����Ϸ�ֹ����IJ������ҹ���2000�������ö�������ȡ������������ˮ������������Ϊ��������ɱ������������ǿ����Ч��������þ�����������ͻ�ש�������Ȣ�������ʹˮ�е����������ۣ�����Ϊ��ˮ���ݽ�����Ͽ���ʹ���˴���ˮ�࣬ˮ���ǹ����β��Ϣ���������װβ�����������ɼ��ٹ⻯ѧ�����ķ���
A���٢ܢ� B���٢ڢܢ� C���ڢۢܢ� D��ȫ��
 ��������ϵ�д�
��������ϵ�д� ����˼ά����ѵ����ʱ��ѧ��ϵ�д�
����˼ά����ѵ����ʱ��ѧ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ������
��һ��2L���ܱ�������Ͷ�뷴Ӧ�������Ӧ2SO3��g�� 2SO2��g��+O2��g����H��0������SO3�ı仯��ͼ��ʾ��
2SO2��g��+O2��g����H��0������SO3�ı仯��ͼ��ʾ��
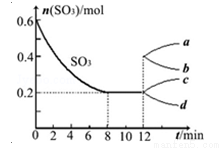
��1������8minʱ����ƽ��,����÷�Ӧ��ƽ�ⳣ��ֵΪ ��
��2����O2��ʾ0��8min�ڸ÷�Ӧ��ƽ������v= ��
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬���� ��
A��v��SO3��=2v��O2��
B��������ѹǿ���ֲ���
C��v��SO2����=2v��O2����
D���������ܶȱ��ֲ���
��4���ڵ�12minʱ������ѹ����1L����SO3�ı仯����Ϊ ��
A��a B��b C��c D��d
��5���������ݻ������ڵ�12minʱ������SO3��g������ƽ���� ��Ӧ�����ƶ�����������桱����SO3��������� �������С������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�갲��ʡ�߶������л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��ϩ��һ����ص����λ�������Ԫ��ϩ�� ���뱽
���뱽
A����Ϊ������ B����Ϊͬ���칹��
C����Ϊͬϵ�� D����Ϊͬ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ�߷����и�����10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��NAΪ�����ӵ�������ֵ�����и���������ȷ����
�ٳ����£�0.1molCl2�ֱ�������NaOH��Һ��ˮ��Ӧ��ת�Ƶĵ�����Ŀ��Ϊ0.1NA
��1 mol Na2O��Na2O2�����������������������3NA
�۱�״���£�44.8 L NO��22.4 LO2��Ϻ������з�������Ϊ2NA
��1L 2mol��L-1��Al(NO3)3��Һ�к�Al3+����Ϊ2NA
��1 L 2 mol/L���Ȼ�����Һ��ȫ�Ƴɽ��壬�������������������С��2 NA
��6.0 g SiO2�����к��еĹ�������ĿΪ0.4 NA
��1 molCH5+�����ĵ�����Ϊ10NA
���ڱ�״���£� 2.8 g N2��2.8 g CO������������Ϊ1.4 NA
2.8 g N2��2.8 g CO������������Ϊ1.4 NA
��300 mL 2 mol/L������Һ������������Ϊ0.6 NA
���״���£�2.24 L�Ҵ�����������C��H����Ϊ 0.5NA
A���ڢۢߢ��� B���٢ڢۢݢ�� C���ڢݢޢߢ� D���٢ڢۢߢ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017������ʡ�߷����и�����10���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
���б�����ȷ����
��ij���ʾ���ѧ�ⶨֻ����һ��Ԫ�أ������Զ϶�������һ����һ�ִ�����;
�ڹ���������������ȼ������FeCl2
��Ũ�����ڹ��������±�ƣ�˵��Ũ����ȶ������ɵ���ɫ����������Ũ����;
��ҽ�����õġ����͡���ɷ���̼�ᱵ��Ư�۵ijɷ�Ϊ�������;
�ݸ�ѹ�ƵƷ����Ļƹ����Զ��������ǿ���ʿ��������
�������ᷴӦ �������һ���Ǽ���������
�������һ���Ǽ���������
A���٢ڢ� B���٢ۢ� C���ڢܢ� D���ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���ຣʡ�߶����¿�һ��ѧ���������棩 ���ͣ������
�������ֳ����£�N2H4����ɫҺ�壩��һ��Ӧ �ù㷺�Ļ���ԭ�ϣ����������ȼ�ϣ��ش��������⣺
�ù㷺�Ļ���ԭ�ϣ����������ȼ�ϣ��ش��������⣺
��1���������ӵĵ���ʽΪ_____________�����е��Ļ��ϼ�Ϊ____________��
��2��ʵ���ҿ��ô���������Һ�백��Ӧ�Ʊ���������Ӧ�Ļ�ѧ����ʽΪ___________��
��3����2O2��g��+N2��g��=N2O4��l�� ��H1
��N2��g��+2H2��g��=N2H4��l�� ��H2
��O2��g��+2H2��g��=2H2O��g�� ��H3
��2N2H4��l��+N2O4 ��l��=3N2��g��+4H2O��g�� ��H4=-1048.9kJ./mol
��l��=3N2��g��+4H2O��g�� ��H4=-1048.9kJ./mol
������Ӧ��ЧӦ֮��Ĺ�ϵʽΪ��H4=_____________��������N2O4����Ϊ����ƽ�������Ҫԭ��Ϊ_______________ ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ���ຣʡ�߶����¿�һ��ѧ���������棩 ���ͣ�ѡ����
��֪��2H2��g����O2��g��=2H2O��l�� ��H����571.6 kJ��mol��1
2CH3OH��l����3O2��g��=2CO2��g����4H2O��l�� ��H����1452 kJ��mol��1
H����aq����OH����aq��=H2O��l�� ��H����57.3 kJ��mol��1
����˵����ȷ���ǣ� ��
A��H2��g����ȼ����Ϊ571.6kJ��mol��1
B��ͬ������H2��g����CH3OH��l����ȫȼ�գ�H2��g���ų���������
C��1/2H2SO4��aq����1/2Ba��OH��2��aq��=1/2BaSO4��s����H2O��l����H����57.3kJ��mol��1
D��3H2��g����CO2��g��=CH3OH��l����H2O��l����H����135.9kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ��һ�ϰ��ڿ��Ի�ѧ���������棩 ���ͣ�ʵ����
��1������250ml0.1mol/L��������Һ
Ӧ��ȡ�������/ml | Ӧѡ������ƿ�Ĺ��/ml | ������ƿ���Ҫ���������� |
|
|
|
��2������ʱ������ȷ�IJ���˳����(��ĸ��ʾ��ÿ����ĸֻ����һ��)
A����30mlˮϴ���ձ�2��3�Σ�ϴ��Һ��ע������ƿ����
B������Ͳȷ��ȡ�����Ũ�����������ز����������ձ��У��ټ�����ˮ(Լ30ml)���ò���������������ʹ���Ͼ���
C������ȴ�������ز�����ע��250ml������ƿ��
D������������ƿ��С�ļ�ˮ��ֱ��Һ��ӽ��̶�1��2cm��
E.������ƿ�ǽ�����ҡ��
F.���ý�ͷ�ιܼ�ˮ��ʹ��Һ����ǡ����̶�����
��3������A�У���ϴ��Һ��ע������ƿ����Ŀ���� ��
��Һע������ƿǰ��ָ������£�������Ϊ ��
��4����ʵ������г������������δ�����
������ˮʱ���������˿̶� ��������ƿ��ת����Һʱ������Һ�ε�������ƿ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016-2017ѧ�����ʡ�߶��ϰ��ڿ��Ի�ѧ���������棩 ���ͣ�ѡ����
��25�桢101kPa�£�1g�� ��ȼ������CO2��Һ̬ˮʱ����22.68 kJ,�����Ȼ�ѧ����ʽ��ȷ����( )
��ȼ������CO2��Һ̬ˮʱ����22.68 kJ,�����Ȼ�ѧ����ʽ��ȷ����( )
A��CH3OH(l)+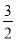 O2(g
O2(g )=CO2(g)+2H2O(l)����H=+725.8 kJ/mol
)=CO2(g)+2H2O(l)����H=+725.8 kJ/mol
B��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)����H=��1452 kJ/mol
C��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)����H=��725.8 kJ/mol
D��2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)����H=+1452 kJ/mol
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com