
| A. | FeCl2 | B. | Fe(OH)3 | C. | Fe(OH)2 | D. | FeCl3 |
分析 A.Fe和FeCl3溶液发生化合反应生成FeCl2;
B.氧气、水和氢氧化亚铁之间反应生成氢氧化铁;
C.FeCl2溶液和NaOH溶液发生复分解反应生成Fe(OH)2;
D.Fe与氯气发生化合反应直接生成FeCl3.
解答 解:A.Fe和FeCl3溶液发生化合反应生成FeCl2,故A错误;
B.O2、水和Fe(OH)2之间反应化合反应生成Fe(OH)3,故B错误;
C.FeCl2溶液和NaOH溶液发生复分解反应生成Fe(OH)2,不能通过一步化和反应得到Fe(OH)2,故C正确;
D.Fe与氯气发生化合反应直接生成FeCl3,故D错误;
故选C.
点评 本题考查物质的性质,为高频考点,把握物质的性质及发生的氧化还原反应为解答的关键,注意利用化合直接生成的信息结合常见的反应实例即可解答,题目难度不大.


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:选择题
| A. | 处理锅炉水垢的CaSO4,可先用Na2CO3溶液处理,再用酸去除 | |
| B. | 向TiCl4中加入大量的水,同时加热,可以制备纳米材料制备TiO2 | |
| C. | AlCl3溶液蒸干灼烧得不到AlCl3,而用SOCl2与AlCl3•6H2O混合共热可得无水AlCl3 | |
| D. | 铵态氮肥不可与草木灰同时使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
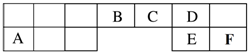
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作及现象 | 溶液 |
| A | 通入CO2,溶液不变浑浊.先通入CO2再通入氨气,溶液变浑浊 | CaCl2溶液 |
| B | 通入CO2,溶液变浑浊.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
| C | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
| D | 通 CO2,溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
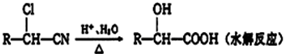
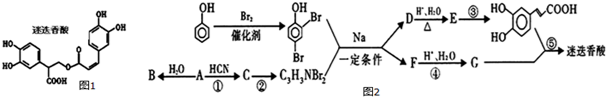
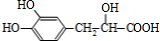 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$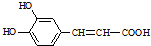 +H2O
+H2O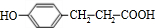 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18g≤m≤128g | B. | 36g<m<180g | C. | 18g<m<128g | D. | 36g<m≤180g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动,逆反应速率减小 | |
| B. | 平衡常数K增大 | |
| C. | NO2的转化率变大 | |
| D. | 容器内气体颜色先变深后变浅,最后比原来还要浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | T2 |
| 水的离子积常数 | 1×10-14 | 1×10-12 |
| 难溶物 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 |
| Ksp | 8.0×10-16 | 8.0×10-38 | 1.0×10-17 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水中加CaCO3后,溶液漂白性增强 | |
| B. | 盛有NO2、N2O4混合气体的烧瓶置于冰水中,气体颜色变浅 | |
| C. | 反应:H2(g)+I2(g)?2HI(g) 达平衡后,减小气体体积,气体颜色变深 | |
| D. | 恒温等容时,在SO2,O2和SO3的平衡体系中加入氧气,提高SO2的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com