
| A、将氢氧化钠固体放在滤纸上称量 |
| B、用100 mL量筒量取8.5 mL蒸馏水 |
| C、制取氯气时,用二氧化锰与浓盐酸在常温下反应,并用排水集气法收集 |
| D、配制氯化铁溶液时,将一定量氯化铁溶解在较浓的盐酸中,再用水稀释到所需浓度 |


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
| A、钠在氧气中燃烧,火焰呈黄色,产生Na2O固体 |
| B、HClO见光分解生成H2O 和Cl2 |
| C、钠投入水中,将沉入水底并熔化成小球、且有气泡产生 |
| D、氯气通入紫色石蕊试液中,溶液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大量食用纯碱可使钙离子沉淀完全,防止胆结石的生成 |
| B、不食用含钙的食品 |
| C、适量服用低维生素E、低维生素C等抗氧化自由基可以防止胆结石 |
| D、手术切除胆囊是最好的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
293 118 |
| A、0 | B、57 | C、118 | D、175 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mL 2mol?L-1 的NaNO3 溶液 |
| B、100mL 0.01mol?L-1 的NaCl溶液 |
| C、20mL 0.05mol?L-1 的Na2SO4 溶液 |
| D、10mL 0.2mol?L-1 的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

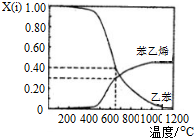
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1项 | B、2项 | C、3项 | D、4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L乙烯含有的极性共价键数为NA |
| B、常温下,5.6LNO和5.6LO2的混合气体中分子数为0.5NA |
| C、7.8gNa2O2固体中阴、阳离子总数为0.3NA |
| D、含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子符号 | K+ | SO42- | Cl- |
| 物质的量浓度(mol?L-1) | 9.0 | 4.0 | 9.0 |
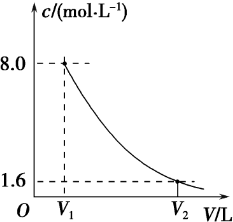
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com