
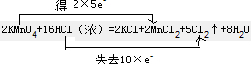
 ,
, ;
;| 7.3g |
| 36.5g/mol |
| 5 |
| 16 |


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:
| A、①③⑤ | B、①②④⑤ |
| C、②④ | D、①③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
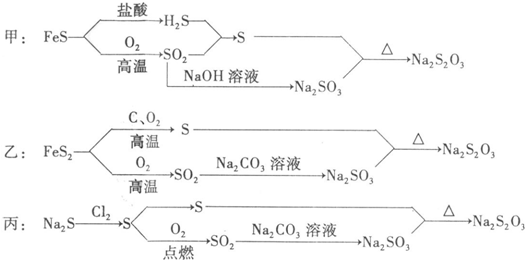
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 乙烯、苯是两种来自石油和煤的基本化工原料;乙醇和乙酸是两种生活中常见的有机化合物.
乙烯、苯是两种来自石油和煤的基本化工原料;乙醇和乙酸是两种生活中常见的有机化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:
如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
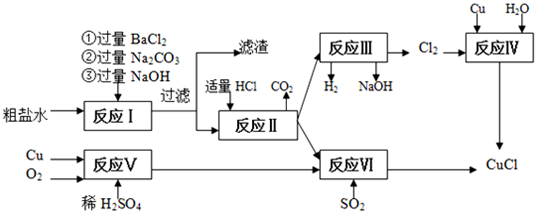
查看答案和解析>>
科目:高中化学 来源: 题型:
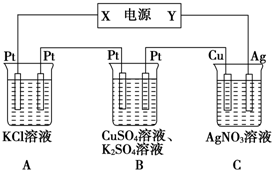
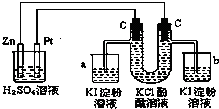 按照图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):
按照图接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、H+、NO3-、SO32- |
| B、H+、K+、CO32-、Cl- |
| C、NH4+、Cl-、Fe2+、OH- |
| D、Na+、K+、OH-、CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com