
分析 (1)根据化学式改写成相应的氧化物得形式,按照活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序来书写,并要遵守原子守恒来分析解答;
(2)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅;
(3)氯酸钠和浓盐酸反应能生成二氧化氯、氯气、水和氯化钠.
解答 解:(1)铝的氧化物为Al2O3,硅的氧化物为SiO2,氢的氧化物为H2O,则根据活泼金属氧化物.较活泼金属氧化物.SiO2.H2O得顺序可知,[Al2Si2O5(OH)4]可改成Al2O3•2SiO2•2H2O,
故答案为:Al2O3•2SiO2•2H2O;
(2)玻璃中含有二氧化硅,二氧化硅和氢氟酸反应生成四氟化硅,反应方程式为SiO2+4HF=SiF4↑+2H2O,故答案为:SiO2+4HF=SiF4↑+2H2O;
(3)用NaClO3氧化浓盐酸制取ClO2,同时有Cl2生成,且Cl2体积为ClO2的一半,氯酸钠和浓盐酸反应的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl,故答案为:2NaClO3+4HCl(浓)=Cl2↑+2ClO2+2NaCl+2H2O.
点评 本题考查将复杂化合物写出氧化物的形式、方程式是书写,明确物质的性质是解本题关键,根据反应物、生成物及反应条件书写方程式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 一个反应能否自发进行,由焓变、熵变、反应温度共同决定 | |
| B. | 在同一条件下,不同物质有不同的熵变,其体系混乱度越大,熵值越小 | |
| C. | 自发进行的反应一定能迅速发生 | |
| D. | 低温时,吸热且熵减的反应可能会自发发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.
污鸡净的主要成分是KMnO4和H2C2O4,可用于洗涤有霉斑的衣物.某小组同学拟探究H2C2O4浓度对反应速率的影响.| 实验序号 | 温度/℃ | 各物质的体积/mL | 反应时间 | |||
| H2O | 3mol/L稀硫酸 | 0.1mol/L KMnO4溶液 | 0.6mol/LH2C2O4溶液 | |||
| 1 | 25 | 3.0 | 2.0 | 4.0 | 6.0 | t1 |
| 2 | ① | 5.0 | 2.0 | 4.0 | 4.0 | t2 |
| 3 | 25 | ② | 2.0 | 4.0 | 2.0 | t3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入大量CO2的溶液中:K+、ClO-、SO32-、HCO3- | |
| B. | 能使蓝色石蕊试纸变红色的溶液中:K+、Na+、CO32-、NO3- | |
| C. | 含有较多Al3+的溶液:Na+、SO42-、I-、ClO- | |
| D. | c(H+):c(OH-)=1:1012的水溶液中:CO32-、Na+、NO3-、AlO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.
现有含有少量KCl、K2SO4、K2CO3杂质的KNO3溶液,选择适当的试剂除去杂质,得到纯净的KNO3固体,实验流程如图所示.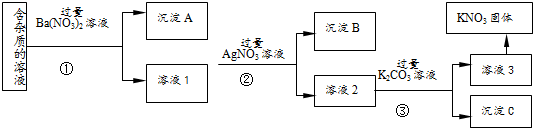
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏法可实现海水的淡化 | |
| B. | 乙醇可以用作“提取碘水中的碘”的萃取剂 | |
| C. | 用“蒸发结晶”的方法从氯化钠溶液中分离得到氯化钠晶体 | |
| D. | 除去氧化铁中的氧化铝杂质:用NaOH溶液浸泡,再过滤、洗涤、干燥,即可得到纯净氧化铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
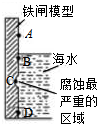 铁及其化合物与生产、生活关系密切,
铁及其化合物与生产、生活关系密切,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡逆向移动 | B. | 混合气体颜色比原来深 | ||
| C. | 混合气体颜色比原来浅 | D. | 混合气体的平均相对分子质量变小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com