
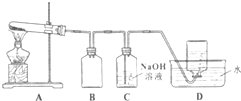
 为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验.| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入KSCN溶液, 振荡 | ① | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入 ②, 振荡 | ③ | 存在Fe2+ |
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
分析 本题以探究AgNO3固的氧化性和稳定性为载体,通过检验溶液里的Fe2+、Fe3+的存在来推测AgNO3固的氧化性,通常是利用KSCN溶液检验Fe3+、酸性的KMnO4溶液检验Fe2+,在探究AgNO3稳定性时通过分解的气体产物和对固体成分的分析来推测,涉及了Ag和Ag2O溶解在稀硝酸中的不同实验现象来确定,据此可作答;
(1)依据铁离子与硫氰酸钾溶液反应生成血红色溶液验证铁离子的存在;亚铁离子的检验是利用酸性KMnO4溶液的强氧化性,通过溶液是否褪色来判断;
(2)装置中B为安全瓶防倒吸;
(3)依据氧气助燃性检验;
(4)实验操作加入氨水,固体不溶解,只能得出固体成分是Ag,实验操作加入的试剂若是硝酸,固体溶解,银单质反应溶解,氧化银也能溶于硝酸;
②装置A加热AgNO3固体,产生红棕色气体为二氧化氮,在装置D中收集到无色气体为氧气,依据实验a可知产物为银,氧化银溶于氨水;
解答 解:(1)取少量除尽Ag+后的溶液于试管中,加入KSCN溶液,振荡,溶液变血红色,证明含有铁离子,验证亚铁离子实验是取少量除尽Ag+后的溶液于试管中,加入酸性的KMnO4溶液,发现溶液紫色褪去,可证明溶液中含有Fe2+,故答案为:①溶液呈血红色;②酸性的KMnO4溶液;③溶液紫色褪去;
(2)装置导气管略露出胶塞,是安全瓶,可以防止C装置中 的液体到吸入发生装置A,故答案为:防倒吸;
(3)氧气具有助燃性,用带火星的木条伸入集气瓶中,木条复燃证明无色气为氧气,故答案为:用带火星的木条深入集气瓶中,木条复燃证明无色气体为氧气;
(4)①实验a加入氨水,银不能溶解于氨水溶液,Ag2O能溶于氨水中形成银氨溶液,可以验证固体成分的判断,b实验加入的硝酸可以溶解Ag2O,也可以溶解Ag,不能检验固体成分,故答案为:b.
②实验a加入氨水,银不能溶解于氨水溶液,Ag2O能溶于氨水中形成银氨溶液,可以验证固体成分的判断,加入足量氨水,振荡黑色固体不溶解,说明生成的固体为Ag,装置A加热AgNO3固体,产生红棕色气体为二氧化氮,在装置D中收集到无色气体为氧气,AgNO3固体热分解的产物有Ag、NO2、O2,故答案为:Ag、NO2、O2;
点评 本题考查了实验设计的方法和物质实验验证方案分析判断,物质性质的应用是解题关键,题目难度中等.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:选择题
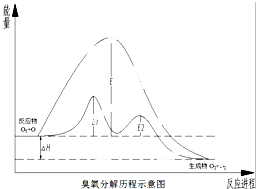 臭氧层中氧分解历程如图所示,下列说法正确的是( )
臭氧层中氧分解历程如图所示,下列说法正确的是( )| A. | 催化反应①②均为放热反应 | |
| B. | 催化剂不能改变该反应的反应热 | |
| C. | ClO是该反应的催化剂 | |
| D. | 在该反应过程中没有化学键的断裂与生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
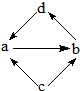 下列各组物质中,物质之间通过一步反应就能实现图所示转化的是
下列各组物质中,物质之间通过一步反应就能实现图所示转化的是| 编号 | a | b | c | d |
| ① | Na2O | Na2O2 | Na | NaOH |
| ② | Al2O3 | NaAlO2 | Al | Al(OH)3 |
| ③ | FeCl2 | FeC13 | Fe | CuCl2 |
| ④ | NO | NO2 | N2 | HNO3 |
| A. | ②③ | B. | ③④ | C. | ①②③ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| M | Y | |
| Z | N |
| A. | 元素Y与元素Z的最高正化合价之和的数值等于13 | |
| B. | 元素Z的含氧酸的酸性比元素N的强 | |
| C. | 离子半径的大小顺序为Z(n+1)->M(n+1)->Yn- | |
| D. | Z的气态氢化物的还原性和热稳定性均比N强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子数之比为3:2 | B. | 同温同压下密度比是2:3 | ||
| C. | 同温同压下质量比是3:2 | D. | 标准状况下体积比是2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时,阳极反应为:Fe-2e-=Fe2+ | |
| B. | 电解过程中阴极能产生氢气 | |
| C. | 电解过程中,Cr2O72-在阳极放电 | |
| D. | 电解过程中,溶液中生成Cr(OH)3和Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
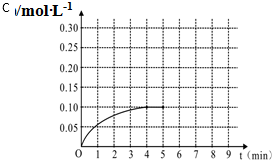 一定温度下,将0.4mol SO2和0.2mol O2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
一定温度下,将0.4mol SO2和0.2mol O2放入固定容积为2L的密闭容器中,发生反应2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ/mol,反应中SO3的物质的量浓度的变化情况如图:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com