
【题目】氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸的原料。氨经一系列反应可以得到硝酸,如图所示:
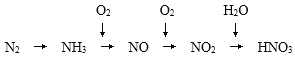
根据已知信息及所学知识回答下列问题:
(1)写出实验室制取氨气的化学方程式_____________;
(2)写出氨的催化氧化的化学方程式_____________;
(3)计算生成1.0mol HNO3需要_______molNH3。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑ 4NH3 + 5O2
CaCl2+2H2O+2NH3↑ 4NH3 + 5O2 ![]() 4NO + 6H2O 1.5
4NO + 6H2O 1.5
【解析】
(1)实验室通过加热氯化铵和氢氧化钙的固体混合物制取氨气;(2)氨在催化剂作用下被氧化生成一氧化氮和水;(3)根据4NH3 + 5O2 ![]() 4NO + 6H2O,2NO + O2 = 2NO2,3NO2 + H2O =2HNO3 + NO计算1.0mol HNO3需要的NH3。据此分析解答。
4NO + 6H2O,2NO + O2 = 2NO2,3NO2 + H2O =2HNO3 + NO计算1.0mol HNO3需要的NH3。据此分析解答。
(1)实验室通过加热氯化铵和氢氧化钙的固体混合物制取氨气,反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2H2O+2NH3↑;
CaCl2+2H2O+2NH3↑;
(2)氨在催化剂作用下被氧化生成一氧化氮和水,反应的化学方程式为4NH3 + 5O2 ![]() 4NO + 6H2O,故答案为:4NH3 + 5O2
4NO + 6H2O,故答案为:4NH3 + 5O2 ![]() 4NO + 6H2O;
4NO + 6H2O;
(3)根据4NH3 + 5O2 ![]() 4NO + 6H2O,2NO + O2 = 2NO2,3NO2 + H2O =2HNO3 + NO可得3NH3~3NO ~3NO2~2HNO3,因此生成1.0mol HNO3需要1.5molNH3,故答案为:1.5。
4NO + 6H2O,2NO + O2 = 2NO2,3NO2 + H2O =2HNO3 + NO可得3NH3~3NO ~3NO2~2HNO3,因此生成1.0mol HNO3需要1.5molNH3,故答案为:1.5。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】写出下列化合物的电子式
(1)K2O_____;
(2)Na2O2_____;
(3)NH4F_____;
(4)Ca(OH)2_____;
(5)CH4_____;
(6)H2O2_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图装置中,烧瓶中充满干燥气体a。将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满整个烧瓶。a和b可能是

a(干燥气体) | b(液体) | |
① | NH3 | 水 |
② | CO2 | 饱和NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NO2 | 水 |
⑤ | HCl | 0.1 mol·L1AgNO3溶液 |
A. ①②③ B. ①②⑤ C. ②④⑤ D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以有机物A合成聚酯类高分子化合物F的路线如下图所示:

已知:①RCH=CH2 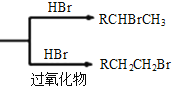 ②丙酮能被KMnO4(H+)氧化,使之褪色
②丙酮能被KMnO4(H+)氧化,使之褪色
(1)A生成B的反应类型为_______,C中含氧官能团的名称为_______。
(2)G是与CH3OH相对分子质量相差56的同系物,且不能使KMnO4(H+)褪色,G的名称为__________________
(3)检验A分子碳碳双键的方法_______________________________________________。
(4)D与NaOH水溶液反应的化学方程式为_____________________________________。
(5)E在一定条件下还可以合成含有六元环结构的H,则H的结构简式为____________。
(6)若F的平均相对分子质量为25200,则其平均聚合度为_______________
(7)满足下列条件的C的同分异构体有____________种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与新制氢氧化铜悬浊液反应产生2mol砖红色沉淀
(8)写出以![]() 为原料(其他试剂任选)制备化合物
为原料(其他试剂任选)制备化合物 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示:![]() 目标产物。__________________
目标产物。__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子晶体晶胞结构如图所示,(![]() )X位于立方体的顶点,(○)Y位于立方体的中心,试分析:
)X位于立方体的顶点,(○)Y位于立方体的中心,试分析:

(1)晶体中每个Y同时吸引着________个X,每个X同时吸引着________个Y,该晶体的化学式为________。
(2)晶体中在每个X周围与它最接近且距离相等的X共有________个。
(3)晶体中距离最近的2个X与一个Y形成的夹角∠XYX=________(填角的度数)。
(4)若该立方体的棱长为a cm,晶体密度为ρ g·cm-3,NA为阿伏加德罗常数,则该离子化合物的摩尔质量为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐晶体是由钠离子和氯离子组成的,且均为等距离的交错排列,如图所示。已知食盐的密度是2.2 g/cm3,阿伏加德罗常数为6.02×1023/mol。在食盐晶体中两个距离最近的钠离子间的距离最接近于 厘米(保留整数)。
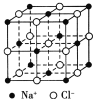
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯酚(HOC6H4NH2)是一种重要的有机合成中间体,可用硝基苯(C6H5NO2)电解还原制备,装置如图所示。下列说法正确的是
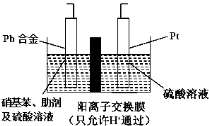
A.电解时Pt电极应与直流电源的负极相连
B.电解时Pt电极上有H2放出
C.阴极反式为:C6H5NO2+4e-+4H+===HOC6H4NH2+H2O
D.电解一段时间后,硫酸溶液的pH不变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的化工原料,可用于自来水消毒。1868年,狄肯等科学家发明了在氯化铜催化并加热的条件下,利用空气中的氧气氧化氯化氢制取氯气的方法,译为地康法。其原理可表示为4HCl+O2![]() 2H2O+2Cl2,下列说法正确的是()
2H2O+2Cl2,下列说法正确的是()
A. Cl2是还原产物
B. 生成11.2LCl2(标准状况),转移电子数目为2NA
C. 反应中Cl被氧化,HCl得到电子
D. 氧化性:O2>Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,B与C能层数相同,D与E能层数相同,C与D价电子结构相同,基态时B、C、D原子核外皆有2个未成对电子,A、E只有1个未成对电子,A能分别与B、C、D、E形成不同的分子。
(1)写出基态时B的价电子排布图 ,E—的原子结构示意图 。
(2)写出BCD的电子式 ,E2C的结构式 。
(3)根据题目要求完成以下填空:
EC3—中心原子杂化方式 ;DC3中心原子杂化方式 ;
EC4—微粒中的键角 ;BC32—微粒的键角 ;
DE2分子的立体构型 ;B2A2分子的立体构型 。
(4)一种由A、B、C三种元素组成的分子A2BC2,该分子中σ键数目为 ,π键数目为 。
(5)根据等电子原理,指出与BC2互为等电子体的离子 (一种即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com