
下列叙述正确的是
A.1 mol H2的质量与它的相对分子质量相等
B.CH4的摩尔质量为16g
C.3.01×1023个SO2分子的质量为32g
D.摩尔是物质的量的单位,符号为 n
 习题精选系列答案
习题精选系列答案科目:高中化学 来源:2016届河北邯郸第一中学高三一轮收官考试一理综化学卷(解析版) 题型:选择题
几种短周期元素的原子半径及主要化合价如表所示:
元素代号 | X | Y | Z | W |
原子半径/pm | 160 | 143 | 70 | 66 |
主要化合价 | +2 | +3 | +5.+3.-3 | -2 |
下列叙述正确的是( )
A.X、Y元素的金属性:X<Y
B.一定条件下,Z单质与W的常见单质直接生成ZW2
C.Y的最高价氧化物对应的水化物能溶于稀氨水
D.一定条件下,W单质可以将Z单质从其氢化物中置换出来
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南南阳第一中学高一上第二次月考化学卷(解析版) 题型:选择题
下图中“—”表示相连的物质间在一定条件下可以反应,“→”表示丁在一定条件下可以转化为乙,下面四组选项中,符合图示要求的是()

甲 | 乙 | 丙 | 丁 | |
A. | H2SO4 | Na2SO4 | NaOH | NaCl |
B. | KCl | K2CO3 | KOH | HCl |
C. | O2 | CO2 | CuO | C |
D. | Fe | CuCl2 | Zn | HCl |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南国兴中学高二上第三次月考化学试卷(解析版) 题型:选择题
由乙烯和苯推测苯乙烯的结构或性质正确的是
A.1 mol苯乙烯可以和4mol Br2发生加成反应
B.分子中所有原子可以在同一平面内
C.与HCl加成只生成一种产物
D.能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:实验题
实验室需要配制0.50 mol/L NaCl溶液480 mL,现使用NaCl固体配制,按下列操作步骤填上适当的文字,以使整个操作完整。
Ⅰ.(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、__________、_________________以及等质量的两片滤纸。
(2)计算。配制该溶液需取NaCl晶体________ g。
(3)称量。
①天平调平。 ②称量。 ③称量完毕,将药品倒入烧杯中。
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________________。
(5)转移、洗涤。在转移时应使用________引流,需要洗涤烧杯2~3次是为了_______________________。
(6)定容、摇匀。
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶中,并贴好标签,注明配制的时间、溶液名称及浓度。
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会______(填“偏高”、“偏低”或“无影响”)。
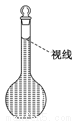
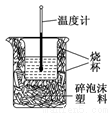
Ⅱ.实验室利用如图装置进行中和热的测定,请回答下列问题:
(1)该图中有两处未画出,它们是________________,________________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________________。
(3)如用0.5 mol/L的盐酸与NaOH固体进行实验,则实验中测得的“中和热”数值将________(填“偏大”、“偏小”、“不变”);原因是_______________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上第一次月考化学试卷(解析版) 题型:选择题
下列各组物质中,第一种是酸,第二种是混合物,第三种是碱的是
A. 碳酸、硫酸铜、烧碱 B. 硫酸、空气、纯碱
C. 盐酸、胆矾、熟石灰 D. 硝酸、食盐水、烧碱
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林实验中学高一上学期期中考试化学试卷(解析版) 题型:选择题
容量瓶上需标有:①温度 ②浓度 ③容量  ④压强 ⑤刻度线 ⑥酸式或碱式;六项中的
④压强 ⑤刻度线 ⑥酸式或碱式;六项中的
A.①③⑤ B.③⑤⑥ C.①②④ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高二上学期期中测试化学试卷(解析版) 题型:填空题
在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,如下反应:CO2(g)+H2(g)  CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g)  CO2(g)+H2(g)的平衡常数K2=________,反应
CO2(g)+H2(g)的平衡常数K2=________,反应  CO2(g)+
CO2(g)+ H2(g)
H2(g) 
 CO(g)+
CO(g)+ H2O(g)的平衡常数K3=________。
H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是______。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正________v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省温州十校联合体高二上学期期中测试化学试卷(解析版) 题型:选择题
2008年,美籍华裔科学家钱永健获得2008年度诺贝尔化学奖。16岁时,他凭借一个金属易受硫氰酸盐腐蚀的调查项目,荣获“美国西屋天才奖”。下列叙述正确的是
A.金属腐蚀就是金属失去电子被还原的过程
B.水库中的水闸(钢板)与外加直流电源的负极相连,正极连接到一块废铁上可防止水闸被腐蚀
C.纯银质物品久置表面变暗,是银发生吸氧腐蚀的结果
D.钢板上的铁铆钉处在潮湿的空气中直接发生反应:Fe-3e-==Fe3+,继而形成铁锈
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com