
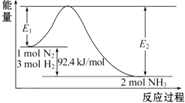
 工业合成氨反应的能量变化如图所示.
工业合成氨反应的能量变化如图所示.
分析 (1)△H=反应物的活化能-生成物的活化能;
(2)反应容器体积不变,加入不相关的气体,相关气体浓度不变;合成氨为可逆反应;
(3)反应达到平衡状态时,同一物质的正逆反应速率相等,平衡时各种物质的物质的量浓度、百分含量等不再发生变化,以及由此衍生的一些量也不发生变化,说明可逆反应到达平衡状态,结合图象分析.
解答 解:(1)△H=反应物的活化能-生成物的活化能,-92.4KJ/mol=E1-E2,该热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol;
(2)反应容器体积不变,加入不相关的气体,相关气体浓度不变,反应速率相等;合成氨为可逆反应,反应物不能完全转化,放热少,故答案为:等于;小于;)
(3)A.对与固定的反应焓变是固定不变的,与平衡状态无关,故A错误;
B.随着反应的进行,气体物质的量减小,气体的质量不变,则混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不变时即是平衡状态,故B正确;
C.随着反应的进行,N2体积分数Φ(N2)逐渐减小,当Φ(N2)不变时即是平衡状态,故C正确;
D.容器的体积不变,气体的质量守恒,则混合气体的密度始终不变,所以混合气体的密度不变时,不一定是平衡状态,故D错误;
故答案为:BC.
点评 本题考查了催化剂的催化原理、反应热的求算、可逆反应的反应热、反应自发进行的条件,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应①为氧化还原反应,反应②为复分解反应 | |
| B. | 反应①中物质氧化性的强弱顺序是:NaClO>Na2FeO4>FeCl3 | |
| C. | 若有2mol FeCl3 发生反应,转移电子的物质的量为 6mol | |
| D. | Na2FeO4能杀菌消毒是因为溶于水产生Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.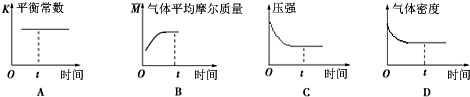
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O和Na2O2均能与H2O反应生成NaOH,故二者都是碱性氧化物 | |
| B. | 根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 | |
| C. | 根据水溶液能否导电将化合物分为电解质和非电解质 | |
| D. | 碱性氧化物一定是金属氧化物,酸性氧化物不一定是非金属氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4 L H2 | B. | 含3.01×1023 个分子的Cl2 | ||
| C. | 10g NH3 | D. | 0.8 mol SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| B. | 中和等体积、等物质的量浓度的盐酸和醋酸溶液,盐酸所需氢氧化钠等于醋酸 | |
| C. | 将氢氧化钠和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的$\frac{1}{2}$ | |
| D. | 如果盐酸的浓度是醋酸浓度的二倍,则盐酸的H+浓度也是醋酸的二倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
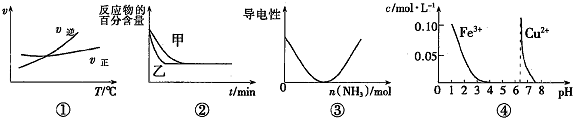
| A. | 据图①可判断可逆反应A2(g)+3B2(g)?2AB3(g)的△H>0 | |
| B. | 图②表示压强对可逆反应2A(g)+B(g)?3C(g)+D(s)的影响,乙的压强大 | |
| C. | 图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化 | |
| D. | 据图④,若除去0.1 mol•L-1CuSO4溶液中混有的Fe3+,可向溶液中加入适量NaOH至pH约为7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com