
【题目】Ⅰ.某温度时,在2 L密闭容器中,三种气态物质X、Y、Z的物质的量(n)随时间(t)变化的曲线如图所示,由图中数据分析可得:
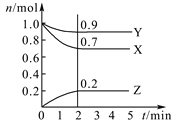
(1)该反应的化学方程式为___________________。
(2)反应开始至2 min,用Y表示的平均反应速率为__________mol/L·min,X的转化率为_________。
(3)在一定温度下,下列情况可作为上述反应达到反应限度的标志的是________。
A.X、Y、Z的浓度相等
B.X、Y、Z的分子数比为3︰1︰2
C.Z的生成速率是Y的生成速率的二倍
D.单位时间内生成n mol Y,同时生成3n mol X
Ⅱ.根据如下图的原电池装置,完成下列内容
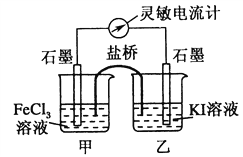
(4)该装置左池为________极,电极反应式为_____________。
(5)过一段时间后往右池中滴加淀粉溶液,现象是______________。
【答案】 3X+Y![]() 2Z 0.025 30% C 正 Fe3++e—=Fe2+ 溶液变蓝
2Z 0.025 30% C 正 Fe3++e—=Fe2+ 溶液变蓝
【解析】I.本题考查化学反应速率的计算和化学平衡状态的判断,(1)X和Y物质的量减少,即为反应物,Z的物质的量增大,即为生成物,同一容器中,化学反应速率之比等于物质的量变化之比,等于化学计量数之比,即X、Y、Z的化学计量数之比为(1-0.7):(1-0.9):0.2=3:1:2,反应方程式为3X+Y![]() 2Z;(2)根据化学反应速率的数学表达式,v(Y)=0.1/(2×2)mol/(L·min)=0.025 mol/(L·min);X的转化率为(1-0.7)/1×100%=30%;(3)A、根据化学平衡状态的定义,是组分的浓度不变,而不是组分的浓度相等,因此不能说明达到平衡,故A错误;B、题目中没有说明开始通入组分的量,因此不能判断是否达到平衡,故B错误;C、用不同物质的化学反应速率表示达到平衡,要求反应方向是一正一逆,且反应速率之比等于化学计量数之比,生成Z说明反应向正反应方向进行,生成Y说明反应向逆反应方向进行,生成Z的速率是生成Y速率的二倍,说明速率之比等于化学计量数之比,因此能说明反应达到平衡,故C正确;D、根据选项C的分析,此反应都是向逆反应方向进行,不能说明达到平衡,故D错误;II.本题考查原电池的工作原理,(4)根据原电池的工作原理,正极上得到电子,化合价降低,发生还原反应,负极上失去电子,化合价升高,发生氧化反应,电池总反应是2Fe3++2I-=2Fe2++I2,因此装置的左池为正极,电极反应式为Fe3++e-=Fe2+;(5)装置右池反应式为2I--2e-=I2,滴加淀粉溶液,溶液变蓝。
2Z;(2)根据化学反应速率的数学表达式,v(Y)=0.1/(2×2)mol/(L·min)=0.025 mol/(L·min);X的转化率为(1-0.7)/1×100%=30%;(3)A、根据化学平衡状态的定义,是组分的浓度不变,而不是组分的浓度相等,因此不能说明达到平衡,故A错误;B、题目中没有说明开始通入组分的量,因此不能判断是否达到平衡,故B错误;C、用不同物质的化学反应速率表示达到平衡,要求反应方向是一正一逆,且反应速率之比等于化学计量数之比,生成Z说明反应向正反应方向进行,生成Y说明反应向逆反应方向进行,生成Z的速率是生成Y速率的二倍,说明速率之比等于化学计量数之比,因此能说明反应达到平衡,故C正确;D、根据选项C的分析,此反应都是向逆反应方向进行,不能说明达到平衡,故D错误;II.本题考查原电池的工作原理,(4)根据原电池的工作原理,正极上得到电子,化合价降低,发生还原反应,负极上失去电子,化合价升高,发生氧化反应,电池总反应是2Fe3++2I-=2Fe2++I2,因此装置的左池为正极,电极反应式为Fe3++e-=Fe2+;(5)装置右池反应式为2I--2e-=I2,滴加淀粉溶液,溶液变蓝。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,用O.lOmol·L-lNaOH溶液,分别滴定40.OOmL浓度均为0.lOmol·L-lCH3COOH溶液和HCN溶液,所得滴定曲线如右图。下列说法正确的是
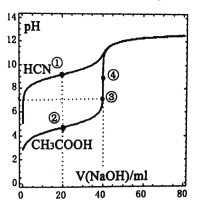
A.点①和点②所示溶液中: c(CH3COOH)-c(CN-)=c(HCN)-c(CH3COO-)
B.醋酸的滴定终点是③
C.滴定CH3COOH过程中不可能出现: c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(0H-)
D.滴定HCN过程中可以用酚酞试液指示终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在材料领域中应用广泛。下列说法正确的是( )
A.水晶项链是硅酸盐制品
B.硅单质广泛用于光纤通讯
C.利用盐酸刻蚀石英制作艺术品
D.硅酸钠可用于制备木材防火剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A和B,只由C、H、O两种或三种元素组成,相同物质的量的A和B完全燃烧时,消耗氧气的物质的量相等,下列对A、B的判断错误的是
A.A与B可能互为同分异构体
B.A与B的分子组成可能相差n个“CH2”
C.A与B的分子组成可能相差n个“CO2”
D.A与B的分子组成可能相差n个“H2O”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是
HCN | S8 | |
结构模型示意图 |
|
|
备注 | - | 易溶于CS2 |
SF6 | B12结构单元 | |
结构模型示意图 |
|
|
备注 | - | 熔点1873K |
A. HCN的结构式为H—C≡N
B. 固态硫S8属于原子晶体
C. SF6是由极性键构成的非极性分子
D. 单质硼属原子晶体,结构单元中含有30个B—B键,含20个正三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列括号中的分离方法运用得当的是( )
A.植物油和水(蒸馏)
B.水溶液中的食盐和碘(分液)
C.CaCO3和CaCl2(溶解、过滤、蒸发)
D.自来水中的杂质(萃取)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况,试判断哪些违反了泡利原理____________,哪些违反了洪特规则_______________。哪些既没有违反泡利原理又没有违反洪特规则_______________。

(Ⅱ)等电子原理:原子数相同、最外层电子总数相同的分子互称为等电子体。等电子体的结构相似、物理性质相近。
(1)根据上述原理,仅由第二周期元素组成的分子中,互为等电子体的是:______和______;______和______.
(2)此后,等电子原理又有所发展.例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征.在短周期元素组成的物质中,与NO2-互为等电子体的分子有:______、______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com