
【题目】近几年来关于氮污染的治理倍受关注。
(1)三效催化剂是最为常见的汽车尾气催化剂,能同时实现汽车尾气中的CO、CxHy、NOx三种成分的净化,其催化剂表面物质转化的关系如图1所示,化合物X可借助傅里叶红外光谱图(如图2所示)确定。

①在图示的转化中,被还原的元素是 ,X的化学式为 。
②氮元素在周期表中的位置是 。
(2)SCR技术可使NOx与NH3直接反应,实现无害转化。当NO与NO2的物质的量之比为2∶1时,写出发生反应的化学方程式: 。已知NOx与NH3的反应△H<0,为提高氮氧化物的转化率可采取的措施是 (任写一条)。
(3)利用ClO2 氧化氮氧化物反应过程如下:NO![]() NO2
NO2![]() N2。反应Ⅰ的化学方程式是2NO + ClO2 + H2O
N2。反应Ⅰ的化学方程式是2NO + ClO2 + H2O![]() NO2 + HNO3 + HCl,反应Ⅱ的离子方程式是 。
NO2 + HNO3 + HCl,反应Ⅱ的离子方程式是 。
(4)加入过量次氯酸钠可使废水中![]() 完全转化为N2,而本身被还原为NaCl。
完全转化为N2,而本身被还原为NaCl。
①写出次氯酸钠的电子式_____________________。
②检验废水中是否存在![]() 的方法是 。
的方法是 。
③若处理废水产生了0.448 L N2(标准状况),则需消耗浓度为2 mol·L1的次氯酸钠的体积为 mL。
【答案】(1)①N、O Ba(NO3)2 ②第二周期第ⅤA族
(2)16NH3 + 12NO + 6NO2![]() 17N2 + 24H2O 增大NH3浓度(降低温度)
17N2 + 24H2O 增大NH3浓度(降低温度)
(3) 2NO2 + 4![]()
![]() N2 + 4
N2 + 4![]()
(4)①![]()
②取少量溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口。若试纸变蓝,则溶液中含有![]()
③30
【解析】本题考查氧化还原反应物质的作用、性质以及有关计算等。(1)①根据图示可知,在图示的转化中,NOx中的N元素的化合价部分降低,O2中的O元素的化合价降低,得到电子,被还原;所以被还原的元素是N、O;其中的部分NOx中的N元素的化合价部分升高,变为HNO3,与BaO发生反应,形成Ba(NO3)2,所以形成的X的化学式为Ba(NO3)2;②氮元素在周期表中的位置是第二周期第ⅤA族;
(2)SCR技术可使NOx与NH3的直接反应,实现无害转化。当NO与NO2的物质的量之比为2∶1时,根据电子守恒、原子守恒,可得发生反应的化学方程式是16NH3 + 12NO + 6NO2 ![]() 17N2 + 24H2O;已知NOx与NH3的反应△H<0,所以为提高氮氧化物的转化率可采取的措施是增大NH3浓度(降低温度);
17N2 + 24H2O;已知NOx与NH3的反应△H<0,所以为提高氮氧化物的转化率可采取的措施是增大NH3浓度(降低温度);
(3)NO2氧化亚硫酸钠的离子方程式为2NO2 + 4![]()
![]() N2 + 4
N2 + 4![]() ;
;
(4)①次氯酸钠是离子化合物,的电子式为![]() 。
。
②氨气是碱性气体,则检验铵根的方法是:取少量溶液于试管中,向其中加入浓NaOH溶液,加热,用湿润的红色石蕊试纸接近试管口,若试纸变蓝,则溶液中含有![]() 。
。
③若处理废水产生了0.448 L N2(标准状况),反应中转移电子的物质的量=![]() 0.12 mol。氯元素的化合价从+1价降低到1价,一个Cl原子得到2个电子,所以根据电子得失守恒可知需要0.06 mol次氯酸钠,溶液的体积为0.06 mol÷2 mol·L1=0.03 L=30 mL。
0.12 mol。氯元素的化合价从+1价降低到1价,一个Cl原子得到2个电子,所以根据电子得失守恒可知需要0.06 mol次氯酸钠,溶液的体积为0.06 mol÷2 mol·L1=0.03 L=30 mL。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了避免青铜器生成铜绿,以下方法正确的是 ( )
A.将青铜器放在银质托盘上B.将青铜器与直流电源的正极相连
C.将青铜器保存在潮湿的空气中D.在青铜器的表面覆盖一层防渗的高分子膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)某混合物浆液含有Al(OH)3、MnO2和少量Na2CrO4,。考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置(见图2),使浆液分离成固体混合物和含铬元素溶液,并回收利用。回答Ⅰ和Ⅱ中的问题。
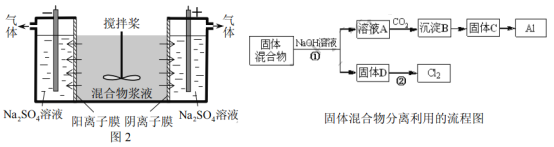
Ⅰ.固体混合物的分离和利用(流程图中的部分分离操作和反应条件未标明)
(1)反应①所加试剂NaOH的电子式为_________。B→C的反应条件为__________,C→Al的制备方法称为______________。
(2)该小组探究反应②发生的条件。D与浓盐酸混合,不加热,无变化,加热有Cl2生成,当反应停止后,固体有剩余,此时滴加硫酸,又产生Cl2。由此判断影响该反应有效进行的因素有(填序号)___________。
a.温度 b.Cl-的浓度 c.溶液的酸度
(3)0.1 mol Cl2与焦炭、TiO2完全反应,生成一种还原性气体和一种易水解成TiO2·xH2O的液态化合物,放热4.28 kJ,该反应的热化学方程式为__________。
Ⅱ.含铬元素溶液的分离和利用
(4)用惰性电极电解时,![]() 能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
能从浆液中分离出来的原因是__________,分离后含铬元素的粒子是_________;阴极室生成的物质为___________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A.NO2、SO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足8电子稳定结构
B.P4和CH4都是正四面体形分子且键角都为109°28′
C.NH4+的电子式为 ,离子呈平面正方形结构
,离子呈平面正方形结构
D.NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于元素周期表的说法正确的是
A. 元素周期表有8个主族 B. ⅠA族的元素全部是金属元素
C. 元素周期表有7个周期 D. 短周期是指第一、二周期
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. SiH4比CH4稳定
B. O2-半径比F-的小
C. Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D. P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年IUPAC命名117号元素为TS(中文名“![]() ”,tián),TS的原子核外最外层电子数是7.下列说法不正确的是
”,tián),TS的原子核外最外层电子数是7.下列说法不正确的是
A.TS是第七周期第ⅦA族元素 B.TS的同位素原子具有相同的电子数
C.TS在同族元素中非金属性最弱 D.中子数为176的TS核素符号是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组利用以下装置进行电解氯化铵溶液的实验,其中X为铁,Y为石墨,a为wg质量分数为40%的NH4Cl溶液(滴有酚酞)。
已知:①氧化性:Cl2> Br2>O2 > I2,②NH3+3CuO![]() 3Cu + 3H2O + N2
3Cu + 3H2O + N2

(l)电解过程中,A 装置中可观察到的现象是__________。
(2)请选用上述仪器,组装一套检验产生氢气的装置:_________[按气流方向(用“→”表示),用小写字母表示,装置不重复使用]。
(3)某同学认为将E换成装有碱石灰的干燥管也可以达到相同效果,乙同学认为不合理,其理由是________________。
(4)设计实验检测阳极产生的气体成分(除水蒸气外)。(所选的试剂用字母编号代替)限选试剂:A、3mol/LNaOH溶液 B、品红 C、酸化的淀粉-KI溶液 D、KBr溶液
操作 | 现象和结论 |
将混合气体依次通入________ | __________________ |
(5)电解结束后,加热电解液将NH3完全蒸出,并用水吸收形成200.00mL溶液,取出其中的20.00mL加指示剂后用标准浓度为c mol/L的盐酸溶液滴定,消耗盐酸V mL,则电解制得NH3的产率_________(用化简为整数的含w 、c 、V的代数式表示)。
(6)若实验时反接了正负极,则X极的电极方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com