
| A. | 聚丙烯的结构简式: | |
| B. | 乙炔的分子结构模型示意图: | |
| C. | H2O2的电子式:H+[${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$$\underset{\stackrel{••}{O}}{••}$${\;}_{•}^{•}$]2-H+ | |
| D. | 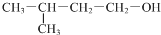 的名称:3-甲基-1-丁醇 的名称:3-甲基-1-丁醇 |
分析 A.聚丙烯的主链只有2个C;
B.乙炔分子中存在碳碳三键,为直线型结构;
C.过氧化氢为共价化合物,分子中不存在阴阳离子;
D.该有机物为醇,根据醇的命名原则判断.
解答 解:A.聚丙烯为丙烯的加聚反应产物,聚丙烯正确的结构简式为: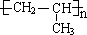 ,故A错误;
,故A错误;
B.乙炔为直线型结构,乙炔正确的比例模型为: ,故B错误;
,故B错误;
C.过氧化氢属于共价化合物,其正确的电子式为: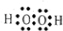 ,故C错误;
,故C错误;
D.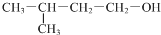 中羟基位于1号C,在3号C含有1个甲基,该有机物名称为:3-甲基-1-丁醇,故D正确;
中羟基位于1号C,在3号C含有1个甲基,该有机物名称为:3-甲基-1-丁醇,故D正确;
故选D.
点评 本题考查化学用语的书写判断,题目难度中等,涉及结构简式、结构示意图、电子式等,把握化学用语的区别及规范应用为解答的关键,注重基础知识的考查.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:解答题
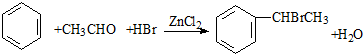 (卤烷基化反应)
(卤烷基化反应)
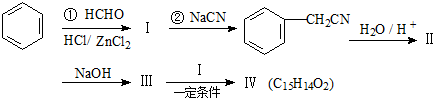
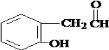 ,
,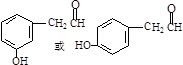 .
.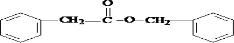 .
.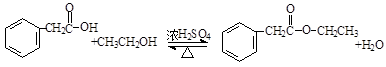 .
.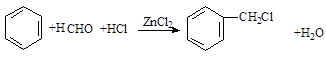 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
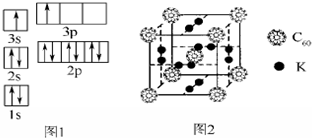 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与过量稀硝酸反应:Fe3O4+8H+→2Fe3++Fe2++4H2O | 正确 |
| B | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液: 2Fe3++3SO42-+3Ba2++6OH-→3BaSO4↓+2Fe(OH)3↓ | 正确 |
| C | 在稀氨水中通入过量CO2:NH3•H2O+CO2→NH4++HCO3- | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应: 2Fe2++2Br-+2Cl2→2Fe3++4Cl-+Br2 | 错误,Fe2+与Br-的化学计量数之比应为1:2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | ||
| Y | Z | W |
| A. | X、Z、W的简单氢化物的稳定性Z>W>X | |
| B. | X元素的单质在化学反应中只表现还原性 | |
| C. | X、Y的简单离子半径Y>X | |
| D. | Y、Z、X的最高价氧化物均能与NaOH溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
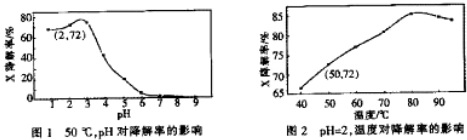
| A. | 温度为50℃,pH在3~6之间,X降解率随pH增大而减小 | |
| B. | pH=2,温度在40~80℃,X降解率温度升高而增大 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | pH=2,温度为50℃,10min内v(X)=1.44×10-4 mol•L-1 min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| A | 其氢化物水溶液呈碱性 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
时间(min) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
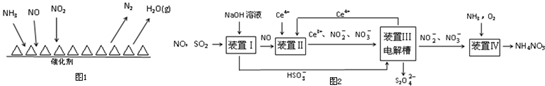
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com