
分析 根据NH3+H2O?NH3•H2O?NH4++OH-知,向氨水中加入酸,氢离子和氢氧根离子反应生成水,导致平衡右移,从而促进氨水电离;向氨水中加入碱,氢氧根离子浓度增大,导致平衡左移,从而抑制氨水电离;向氨水中加入氯化铵,导致溶液中铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,据此分析解答.
解答 解:(1)向氨水中通适量的氯化氢气体,氯化氢溶于水电离出氢离子,氢离子和氢氧根离子反应生成水,导致平衡右移,则溶液中氨气浓度减小,溶液的碱性减弱,所以溶液中氢原子浓度增大,故答案为:减小;增大;
(2)向氨水中加入适量氢氧化钠,氢氧根离子浓度增大,导致平衡左移,则溶液中铵根离子浓度减小,故答案为:减小;增大;
(3)向氨水中加入氯化铵,氯化铵电离出铵根离子,所以溶液中铵根离子浓度增大,平衡向左移动,从而抑制氨水电离,溶液中氢氧根离子浓度减小,故答案为:增大;减小.
点评 本题考查了弱电解质的电离,根据溶液中某种微粒浓度的变化来判断平衡的移动及其它微粒浓度的变化,题目难度不大.


科目:高中化学 来源: 题型:选择题
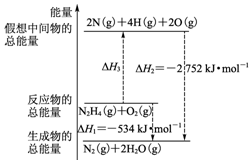 断裂1mol化学键所需的能量如表:
断裂1mol化学键所需的能量如表:| 化学键 | N-N | O=O | N≡N | N-H |
| 键能(kJ) | 154 | 500 | 942 | a |
| A. | N2比O2稳定 | |
| B. | N2H4(g)+O2(g)?N2(g)+2H2O(g)△H=-534 kJ•mol-1 | |
| C. | 表中的a=194 | |
| D. | 图中的△H3=+2218 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化合物甲比乙的沸点低 | |
| B. | X、Y、Z、W的简单离子半径大小为:W>Y>Z>X | |
| C. | 丙属于正盐,其水溶液呈中性 | |
| D. | X和Z形成的二元化合物与乙的化学键类型相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
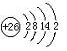 .
.| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
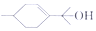 的说法不正确的是( )
的说法不正确的是( )| A. | 有机物的分子式是C10H18O | B. | 能与溴水、钠发生反应 | ||
| C. | 能发生氧化、取代反应 | D. | 与HC1发生加成的产物只有1种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
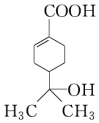
| A. | 分子中含有两种官能团 | |
| B. | 可使溴水和酸性高锰酸钾溶液褪色,且原理相同 | |
| C. | 该有机物的分子式为C10H16O3 | |
| D. | 与钠和氢氧化钠溶液都能发生反应,且得到的产物相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HNO2溶液用水稀释后,H+浓度下降 | |
| B. | HNO2溶液的导电性比盐酸弱 | |
| C. | HNO2溶液不与氯化钠反应 | |
| D. | 0.lmol•L-1的HNO2溶液的c(H+)=l0-2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/nm | 0.160 | 0.143 | 0.070 | 0.066 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | 元素的金属性:X<Y | |
| B. | 原子Z的价电子数为5 | |
| C. | 元素的简单离子半径:r(X2+)>r(W2-) | |
| D. | 元素Y的最高价氧化物对应的水化物能溶于氨水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com