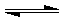
分析:(1)由图1可知,在3min时反应达平衡,D的物质的量变化量为0.6mol,根据v=
计算v(D);
(2)根据图1可知,平衡时反应混合物各组分的物质的量的变化量,利用物质的量的变化量之比等于化学计量数之比,确定m、n、p、q的值,化学平衡常数指生成物浓度的化学计量数次幂的乘积除以各反应物浓度的化学计量数次幂的乘积所得的比值,写出平衡常数表达式,求出平衡时反应混合物各组分的浓度,代入平衡常数表达式计算;
(3)①该反应正反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应移动,D的浓度降低;
②容器的容积压缩为原来的一半,压强增大1倍,改变条件瞬间,平衡未移动是B的浓度为原来2倍,若m+n=p+q,平衡不移动,B的浓度为原来2倍;若m+n>p+q,平衡向正反应移动,B的平衡浓度小于原来2倍,根据平衡常数计算平衡时B的浓度;若m+n<p+q,平衡向逆反应移动,B的平衡浓度大于原来2倍,根据平衡常数计算平衡时B的浓度;
(4)结合平衡常数判断反应进行方向,再结合等效平衡思想判断平衡时A的浓度取值范围;
(5)A.化学反应速率,表示反应快慢物理量;
B.有效碰撞理论研究反应速率快慢;
C.勒夏特列原理可指导怎样使用有限原料多出产品;
D.催化剂的使用提高反应速率;
E.正确利用化学反应速率和化学反应限度都可以提高化工生产的综合经济效益.
解答:解:(1)由图1可知,在3min时反应达平衡,D的浓度变化量为0.6mol/L,v(D)=
=0.1mol/(L?min),故答案为:0.1mol/(L?min);
(2)物质的量的变化量之比等于化学计量数之比,所以(1.0-0.6)mol:(1.0-0.8)mol:0.6mol:0.2mol=m:n:p:q,即
m:n:p:q=2:1:3:1,所以方程式为2A(g)+B(g)
3D(g)+E(s),所以平衡常数k=
,平衡时c(A)=c(D)=
=0.3mol/L,
c(B)=
=0.4mol/L,所以k=
=0.75,故答案为:0.75;
(3)①该反应正反应为放热反应,升高温度,平衡向吸热方向移动,即向逆反应移动,D的浓度降低,所以升高温度,D的物质的量变化曲线最可能的是c,故答案为:c;
②由(2)知该反应反应前后气体体积不变,容器的容积压缩为原来的一半,压强增大1倍,平衡不移动,6min后B浓度为原来2倍,即0.8mol/L,所以6min后B浓度的变化曲线如图

:

故答案为:
(4)开始加入0.4molA、0.8molB、0.9molD和0.5molE,此时的浓度商为
=5.7>0.75,反应向逆反应进行,所以c(A)>
=0.2mol/L,
开始加入0.4molA、0.8molB、0.9molD和0.5molE,按化学计量数转化到左边,可以等效为开始加入1molA、1.1molB、1和0.3molE,B的浓度比原平衡时大,平衡向正反应移动,所以平衡时A的浓度小于原平衡时浓度
=0.3mol/L,所以0.2mol/L<c(A)<0.3mol/L,
故答案为:0.2mol/L<c(A)<0.3mol/L;
(5)A.化学反应速率,表示反应快慢物理量,故A正确;
B.有效碰撞理论研究反应速率快慢,与转化率无关,故B错误;
C.勒夏特列原理是平衡移动原理,可指导怎样使用有限原料多出产品,故C正确;
D.催化剂的使用提高反应速率,不能改变产量,只能缩短到达平衡时间,故D错误;
E.综合经济效益既考虑原料的利用率又要考虑时间,故E正确;
故答案为:BD.

 pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).
pD(g)+qE(s),△H<0(m、n、p、q为最简整数比).


 3D(g)+E(s),所以平衡常数k=
3D(g)+E(s),所以平衡常数k= :
:


 智能训练练测考系列答案
智能训练练测考系列答案