
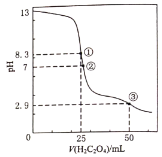
【题目】25℃时,用0.0500mol·L-1H2C2O4(二元弱酸)溶液滴定25.00mL 0.1000mol·L-1NaOH溶液所得滴定曲线如右图。下列说法正确的是
A.点①所示溶液中:![]()
B.点②所示溶液中:![]()
C.滴定过程中可能出现:![]()
D.点③所示溶液中:![]()
【答案】C
【解析】
用0.0500mol·L-1H2C2O4(二元弱酸)溶液滴定25.00mL 0.1000mol·L-1NaOH溶液,反应为H2C2O4+2NaOH=Na2C2O4+2 H2O、H2C2O4+ Na2C2O4=2 NaHC2O4;
A. 点①pH=8.3时,反应生成Na2C2O4,根据电荷守恒进行判断;
B. 点②pH=7,溶液呈中性,c(H+)= c(OH-),再结合电荷守恒进行判断;
C. 滴定过程中点①溶液呈碱性,点②溶液呈中性,点③溶液呈酸性,据此进行判断;
D. 点③溶液呈酸性,溶质为NaHC2O4,据此判断。
用0.0500mol·L-1H2C2O4(二元弱酸)溶液滴定25.00mL 0.1000mol·L-1NaOH溶液,反应为H2C2O4+2NaOH=Na2C2O4+2 H2O、H2C2O4+ Na2C2O4=2 NaHC2O4;
A. 点①pH=8.3时,反应生成Na2C2O4, C2O42-水解生成HC2O4-、H2C2O4,根据电荷守恒有c(Na+)+ c(H+)= 2c(C2O42-)+c(HC2O4-)+ c(H2C2O4)+ c(OH-),根据物料守恒有c(Na+)= 2c(C2O42-)+2c(HC2O4-)+ 2c(H2C2O4),两式结合得c(OH-)= 2 c(H2C2O4) +c(HC2O4-) +c(H+),A项错误;
B. 点②pH=7,溶液呈中性,c(H+)= c(OH-),根据电荷守恒c(Na+)+ c(H+)= 2c(C2O42-)+c(HC2O4-)+c(OH-),可知![]() ,B项错误;
,B项错误;
C. 滴定过程中点①溶液呈碱性,点②溶液呈中性,点③溶液呈酸性,随着草酸的滴入,NaHC2O4逐渐增多,有![]() ,C项正确;
,C项正确;
D. 点③溶液呈酸性,溶质为NaHC2O4,HC2O4-电离程度大于水解程度,故有![]() ,D项错误;
,D项错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】用Na2CO3·10H2O晶体配制0.2mol·L-1Na2CO3溶液230mL。
(1)实验时要用到的玻璃仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是__________,在使用该仪器前必须进行的操作是_______。
(2)应用托盘天平称取Na2CO3·10H2O晶体的质量为___________g。
(3)配制溶液时有多个操作,请简述定容的过程:________。
(4)配制过程中,下列操作会引起所配溶液的浓度偏大的有____(填序号)。
a.Na2CO3·10H2O晶体不纯,混有NaCl
b.用“左码右物”的称量方法称量晶体
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.定容时,俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用相关知识填空.
(1)等质量的SO2和SO3所含氧原子个数之比__________
(2)4.8gCH4中所含氢原子个数与____________g水所含氢原子数相等
(3)12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为_____________,R的相对原子质量是_________
(4)标况下, 16g二氧化碳和一氧化碳组成的混合气体,其体积为8.96L,则该混合气体的密度相对氢气为________,一氧化碳和二氧化碳的物质的量之比为___________,若将此混合气体通入足量的澄清石灰水中,生成的沉淀的质量是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是一个有机物的核磁共振氢谱图,请你观察图谱,分析其可能是下列物质中的 ( )
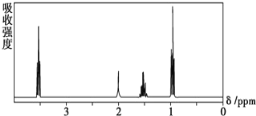
A.CH3CH2CH2CH3B.(CH3)3CCH3
C.CH3CH2CH2OHD.CH3CH2COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )
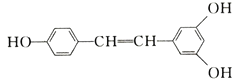
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示(图中电极均为石墨电极)。若用NO2气体进行模拟电解法吸收实验。
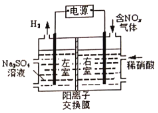
①写出电解时NO2发生反应的电极反应式:________。
②若有标准状况下2.24L NO2被吸收,通过阳离子交换膜(只允许阳离子通过)的H+为___mol。
Ⅱ.汽车尾气是造成雾霾天气的重要原因之一,已知汽车尾气排放时容易发生以下反应:①![]() △H1=+180kJ·mol-1,②
△H1=+180kJ·mol-1,②![]() △H2,③
△H2,③![]() △H3,已知:CO和O2反应相关的化学键键能键能数据如下:
△H3,已知:CO和O2反应相关的化学键键能键能数据如下:

(1)在汽车上安装三元催化转化器可实现反应③,则该反应在________(填高温、低温或任何温度)下能自发进行。
(2)为研究温度、催化剂负载量和不同催化剂对NO去除率的影响。将NO和CO以一定的流速通过不同的催化剂进行反应经过相同时间内测量逸出气体中NO的含量,从而确定尾气脱氮率(脱氮率即NO的转化率),图1是不同负载量的Cu2+实验结果,图2是不同催化剂的实验结果(催化剂①指3%Co2+,催化剂②指3%Cu2+)。
图1 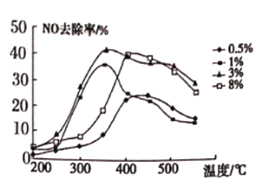 图2
图2 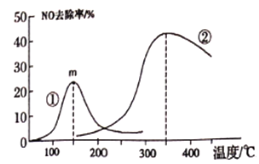
下列说法不正确的是________
A. 图1说明Cu2+含量越高脱氮效果越好
B. 图1说明Cu2+3%的催化剂在350℃左右脱氮效率最高
C. 图2说明第②种催化剂比第①种催化剂脱氮率高
D. 图2说明m点是平衡点
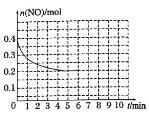
(3)在某温度下,2L密闭容器中充入NO、CO各0.4mol进行反应③,测得NO物质的量变化如图所示,5分钟末反应达到平衡,该反应的平衡常数K=____。第6分钟继续加入0.2mol NO、0.2mol CO、0.2mol CO2和0.3mol N2,请在右图中画出到9分钟末反应达到平衡NO的物质的量随时间的变化曲线____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列各题
(1)下列 3 种有机化合物 A:CH2=CHCH3 B:![]() C:CH3CH2CH2OH
C:CH3CH2CH2OH
①写出化合物 A、C 中的官能团的名称:_____、_____
②A 在催化剂加热条件下生成聚合物的反应方程式:_____。
③C 物质在一定条件下可转化为 A,请写出其化学方程式:_____。
④B 可与 NaOH 溶液反应生成苯酚钠,写出向苯酚钠中通入二氧化碳的化学方程式为:_____。
(2)分子式为 C4H8O2 的物质有多种同分异构体,请写出符合下列要求的各种同分异构体的结 构简式。
已知:a.碳碳双键上连有羟基的结构不稳定 b.不考虑同一个碳原子上连有两个羟基的结构。
①甲分子中没有支链,能与 NaHCO3 溶液反应,则甲的结构简式为_____。
②乙可发生银镜反应,还能与钠反应,则乙可能的结构简式为_____(任写一种)。
③丙可发生银镜反应,还可发生水解反应,则丙可能的结构简式为_____任写一种)。
④丁是一种有果香味的物质,能水解生成 A、B 两种有机物,A 在一定条件下能转化为 B,则 丁的结构简式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
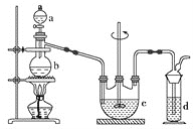
回答下列问题:
(1)a中试剂为__________,b中试剂为__________,c中试剂为____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是______________。
(3)d中的试剂为__________________。
(4)实验中要控制SO2生成速率,可以采取的措施有________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 受热分解的化学方程式为:
受热分解的化学方程式为:![]() 。为检验
。为检验![]() 高温分解的产物,进行如下实验:
高温分解的产物,进行如下实验:
(1)检验产物![]() :少量
:少量![]() 高温分解得到的固体,加入一定量盐酸溶解,再向该溶液中加入适量的KSCN溶液,若有___现象产生,则证明产物中存在
高温分解得到的固体,加入一定量盐酸溶解,再向该溶液中加入适量的KSCN溶液,若有___现象产生,则证明产物中存在![]() 。
。
(2)检验气体产物:将![]() 高温分解产生的气体通入如图三个装置中,以检验产生的气体中是否含有
高温分解产生的气体通入如图三个装置中,以检验产生的气体中是否含有![]() 。
。
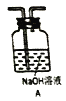
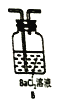
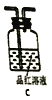
①三个装置的连接序为____(填装置序号);
②气体通过![]() 溶液时可以观察到白色沉淀现象,产生该现象的化学反应为_____(用一个化学反应方程式表示)
溶液时可以观察到白色沉淀现象,产生该现象的化学反应为_____(用一个化学反应方程式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com