
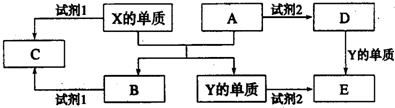
分析 元素X、Y的单质是生活中常见的金属,分别为Al、Fe中的一种,且X与氧化物A反应得到Y与氧化物B,则X为Al,Y为Fe,B为氧化铝,A为Fe的氧化物,若试剂1是NaOH溶液,则C为偏铝酸钠,若试剂1为硫酸,则C为硫酸铝;试剂2为盐酸或硫酸,Y与试剂2反应得到E为亚铁盐,A与酸反应得到盐D,D与Fe反应得到E,则A为氧化铁,若试剂2为盐酸,则E为氯化亚铁,D为氯化铁,若试剂2为硫酸,则E为硫酸亚铁,D为硫酸铁,据此解答.
解答 解:元素X、Y的单质是生活中常见的金属,分别为Al、Fe中的一种,且X与氧化物A反应得到Y与氧化物B,则X为Al,Y为Fe,B为氧化铝,A为Fe的氧化物,若试剂1是NaOH溶液,则C为偏铝酸钠,若试剂1为硫酸,则C为硫酸铝;试剂2为盐酸或硫酸,Y与试剂2反应得到E为亚铁盐,A与酸反应得到盐D,D与Fe反应得到E,则A为氧化铁,若试剂2为盐酸,则E为氯化亚铁,D为氯化铁,若试剂2为硫酸,则E为硫酸亚铁,D为硫酸铁,
(1)X的单质与A反应的化学方程式是:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;
(2)B为氧化铝,B物质的用途为可作耐火材料或耐高温材料,
故答案为:可作耐火材料或耐高温材料;
(3)若试剂1是NaOH溶液,试剂2为盐酸,D为氯化铁,则将氯化铁的饱和溶液滴加到沸水中加热至溶液为红褐色,得到氢氧化铁胶体,发生的离子反应方程式为Fe3++3H2O=Fe(OH)3(胶体)+3H+,
故答案为:Fe3++3H2O=Fe(OH)3(胶体)+3H+;
(4)若试剂1和试剂2均是稀硫酸:
①C为硫酸铝,硫酸铝反应中铝离子水解:Al3++3H2O?Al(OH)3+3H+,破坏水的电离平衡,其溶液呈酸性,
故答案为:Al3++3H2O?Al(OH)3+3H+;
②E为硫酸亚铁,工业上以硫酸亚铁、稀硫酸和亚硝酸钠为原料来制备Fe(OH)SO4,反应中有NO生成,该反应的化学方程式是:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑,
故答案为:2FeSO4+2NaNO2+H2SO4═2Fe(OH)SO4+Na2SO4+2NO↑.
点评 本题考查无机物的推断,涉及Fe、Al元素单质化合物的性质,注意对铝热反应的掌握,在推断中经常涉及,难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
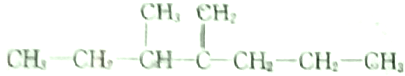 ,此烃名称为3-甲基-2-丙基-1-戊烯
,此烃名称为3-甲基-2-丙基-1-戊烯 ,可命名为1-甲基-3-乙基苯.
,可命名为1-甲基-3-乙基苯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解质在固态时均为离子晶体 | |
| B. | CCl4、Cl2及HF中的原子都满足最外层8电子稳定结构 | |
| C. | 用道尔顿的原子结构理论无法解释同位素现象 | |
| D. | 晶体类型相同,则晶体中化学键也完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
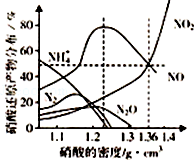 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法错误的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法错误的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液C(H+)=0.1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.32mol/(L•s) | B. | 0.16mol/(L•s) | C. | 0.8mol/(L•s) | D. | 0.08mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
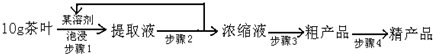
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 没有单质参加的化合反应一定不属于氧化还原反应 | |
| B. | 离子反应一定属于氧化还原反应 | |
| C. | 有的复分解反应属于氧化还原反应 | |
| D. | 置换反应一定属于氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com