
�״���һ�ֺܺõ�ȼ��,��ҵ����CH4��H2OΪԭ��,ͨ����Ӧ��͢����Ʊ��״���
(1)��1.0 mol CH4��2.0 mol H2O(g)ͨ�뷴Ӧ��(�ݻ�Ϊ100 L),��һ�������·�����Ӧ:CH4(g)+H2O(g) CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��
CO(g)+3H2(g)������CH4��ת�������¶ȡ�ѹǿ�Ĺ�ϵ����ͼ��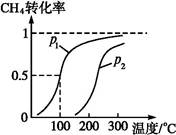
����֪100 ��ѹǿΪp1ʱ�ﵽƽ�������ʱ��Ϊ5 min,����H2��ʾ��ƽ����Ӧ����Ϊ����������
��ͼ�е�p1��������p2(�<����>����="��),100" ��ѹǿΪp2ʱƽ�ⳣ��Ϊ����������
�۸÷�Ӧ�Ħ�H��������0(�<����>����=��)��
(2)��һ��������,��a mol CO��3a mol H2�Ļ�������ڴ������������Է���Ӧ���ɼ״�: CO(g)+2H2(g) CH3OH(g)����H<0 ������
CH3OH(g)����H<0 ������
���������ݻ�����,���д�ʩ�����Ӽ״����ʵ���(����)
A.�����¶�
B.��CH3OH(g)����ϵ�з���
C.����He,ʹ��ϵ��ѹǿ����
D.�ٳ���1 mol CO��3 mol H2
��Ϊ��Ѱ�Һϳɼ״����¶Ⱥ�ѹǿ����������,ijͬѧ���������ʵ��,����ʵ�������Ѿ���������ʵ������С�
A.�±���ʣ���ʵ����������:a=��������;b= ��
��
B.���ݷ�Ӧ����ص�,��ͼ����ѹǿ�ֱ�Ϊ0.1 MPa��5 MPa��CO��ת�������¶ȱ仯������ͼ,��ָ��ͼ�е�ѹǿpx=��������MPa��
| ʵ���� | T/�� | n(CO)/n(H2) | p/MPa |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ijһ�ݻ�Ϊ5 L���ܱ������ڣ�����0.2mol ��CO��0.2mol��H2O��g�����ڴ������ڵ������¸��¼��ȣ��������·�Ӧ��CO��g����H2O��g�� CO2��g����H2��g������Ӧ�ų���������Ӧ��CO2��Ũ����ʱ��仯���������ͼ��ʾ��
CO2��g����H2��g������Ӧ�ų���������Ӧ��CO2��Ũ����ʱ��仯���������ͼ��ʾ��
��1������ͼ�����ݣ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ��CO�Ļ�ѧ��Ӧ����Ϊ________����Ӧƽ��ʱc��H2����________��
��2���жϸ÷�Ӧ�ﵽƽ���������________������ţ���
| A��CO���ٵĻ�ѧ��Ӧ���ʺ�CO2���ٵĻ�ѧ��Ӧ������� |
| B��CO��H2O��CO2��H2��Ũ�ȶ���� |
| C��CO��H2O��CO2��H2��Ũ�ȶ����ٷ����仯 |
| D�������淴Ӧ���ʶ�Ϊ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����ٷɻ���ƽ�������ʱ��β���е�NO���ƻ������㡣��ѧ�������о����ô�������β���е�NO��COת���CO2��N2 , ��ѧ����ʽ���£�2NO + 2 CO 2CO2 + N2 ��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��£������崫������ò�ͬʱ���NO��COŨ�����±���
2CO2 + N2 ��Ϊ�˲ⶨ��ij�ִ��������µķ�Ӧ���ʣ���ij�¶��£������崫������ò�ͬʱ���NO��COŨ�����±���
| ʱ�� /s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol��L��1 | 1.00��10��3 | 4.50��10��4 | 2.50��10��4 | 1.50��10��4 | 1.00��10��4 | 1.00��10��4 |
| c(CO)/mol��L��1 | 3.60��10��3 | 3.05��10��3 | 2.85��10��3 | 2.75��10��3 | 2.70��10��3 | 2.70��10��3 |
| ʵ���� | T / �� | NO��ʼŨ�� ( mol��L��1 ) | CO��ʼŨ�� ( mol��L��1 ) | �����ıȱ���� ( m2��g��1 ) |
| �� | 280 | 1.20 �� 10��3 | 5.80 �� 10��3 | 82 |
| �� | | | | 124 |
| �� | 350 | | | 124 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
һ�������£������Ϊ5 L���ܱ������У���̬����A��B��C�����ʵ���n(mol)��ʱ��t�ı仯��ͼ1��ʾ����֪��ƽ������¶ȣ�A������ٷֺ�������С��
(1)������ͼ���ݣ�д����Ӧ�Ļ�ѧ����ʽ ��
�ӷ�Ӧ��ʼ��ƽ��ʱ��ƽ������v(C)= ��
(2)�÷�Ӧ�Ħ�H 0(���������������=��)��
(3)�˷�Ӧƽ�ⳣ���ı���ʽΪK= ��
(4)�÷�Ӧ�ķ�Ӧ����v��ʱ��t�Ĺ�ϵ��ͼ2��ʾ��
�ٸ�����ͼ�жϣ���t3ʱ�̸ı����������� ��
��A��ת��������һ��ʱ���� ��
�۸��ε�ƽ�ⳣ�������ʾ��
K1��K2��K3֮��Ĺ�ϵΪ�� (�á�>������<����=������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
����þ���仯���ﲻ���ڹ���������ҪӦ�ã��ڻ�ѧ�о���Ҳ�й㷺Ӧ�á�
��1��ijͬѧ�о���Ӧ����ʱ�����·�����ȡһ��þ������ɰֽ��ȥ���������Ĥ��ʹ����þ����һ�������ᷴӦ����H2�����뷴Ӧʱ��Ĺ�ϵ������ͼ��ʾ��þ�����ᷴӦ�����ӷ���ʽΪ ����ǰ4min�ڣ�þ��������ķ�Ӧ�����ӿ죬��4 min֮��Ӧ�����������������ԭ��_____________��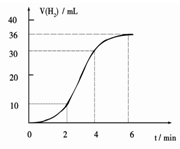
��2����������Mg(OH)2����Һ�м��������ı����Ȼ����Һ��������ȫ�ܽ⣬д��NH4Cl������ҺʹMg(OH)2����Һ�ܽ�����ӷ���ʽ ��
��3��Mg��Al���γ�ԭ���:
| ��� | �缫���� | �������Һ | ������������ |
| 1 | Mg��Al | ϡ���� | Mg����Al |
| 2 | Mg��Al | NaOH��Һ | |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�״���������10��һ25���ļ״�����������ԭ�ϡ����Ӽ��ϳɵ����ͳ���ȼ�ϣ��ɴﵽ�������͵����ܺ�ָ�ꡣ�״���һ�ֿ�������Դ�����й㷺�Ŀ�����Ӧ��ǰ����
��ҵ�Ϻϳɼ״�һ��������з�Ӧ��CO��g��+2 H2��g�� CH3 OH��g�� ��H="a" kJ/mol��
CH3 OH��g�� ��H="a" kJ/mol��
�±��Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K����
| �¶�/0C | 250 | 310 | 350 |
| K | 2.041 | 0.250 | 0.012 |
| Ũ��mol/L ʱ��/min | c(CO) | c(H2) | c(CH3OH) |
| 0 | 0.8 | 1.6 | 0 |
| 2 | 0.6 | 1.2 | 0.2 |
| 4 | 0.3 | 0.6 | 0.5 |
| 6 | 0.3 | 0.6 | 0.5 |
 CH3 OH��g����H="a" kJ/mol�����º����·�Ӧ��ͬʱ��ֱ�����ϵ��CO�İٷֺ����ֱ�Ϊw1��w2����֪T1<T2����
CH3 OH��g����H="a" kJ/mol�����º����·�Ӧ��ͬʱ��ֱ�����ϵ��CO�İٷֺ����ֱ�Ϊw1��w2����֪T1<T2�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��ҵ������Ĺ��������÷�Ӧ2SO2��g����O2��g��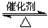 2SO3��g������H��0����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
2SO3��g������H��0����SO2ת��ΪSO3��β��SO2����NaOH��Һ�������ա���ش��������⣺
��1��һ�������£���һ���������ܱ������г���2molSO2��1molO2������Ӧ��������˵����ȷ���� ��
A������Ӧ����v(SO2)=v(SO3)�������˵���ÿ��淴Ӧ�Ѵﵽƽ��״̬
B�������¶Ⱥ�����������䣬����2 mol N2����ѧ��Ӧ���ʼӿ�
C��ƽ��������Ӧ��Ũ�ȣ���ƽ��һ�����ƣ�����Ӧ���ת����һ��������
D��ƽ����ƶ�����ѹ�����壬ƽ��ʱSO2��O2�İٷֺ�����С��SO3�İٷֺ�������
E�������¶Ⱥ�����������䣬ƽ����ٳ���2molSO3���ٴ�ƽ��ʱ�����Ũ�Ⱦ���ԭƽ��ʱ��Ũ�ȴ�
F��ƽ��������¶ȣ�ƽ�ⳣ��K����
��2����һ������SO2��g����O2��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У��ڲ�ͬ�¶��½��з�Ӧ�õ����±��е��������ݣ�
| ʵ���� | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0��8 | 6 |
| 2 | T2 | 4 | 2 | 0��4 | y | 9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�����仯�������������������й㷺Ӧ�á���ش��������⣺
��1��ˮ�ȷ��Ʊ�Fe3O4�������ķ�Ӧ�ǣ�3Fe2����2S2O32-��O2��xOH����Fe3O4����S4O32-��2H2O
���������ӷ���ʽ��x��________��
��ÿ����1 mol Fe3O4����Ӧת�Ƶĵ���Ϊ________mol��
��2��ij��Ч��ˮ������Fe��OH��SO4�ۺϵõ�����ҵ����FeSO4��NaNO2��ϡ����Ϊԭ�����Ʊ�Fe��OH��SO4����Ӧ����NO���ɣ���ѧ����ʽΪ����������������
��¯���������з�������Ҫ��ӦΪ��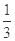 Fe2O3��s��+ CO��g��
Fe2O3��s��+ CO��g�� 
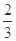 Fe��s��+CO2��g��+Q
Fe��s��+CO2��g��+Q
��֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����£�
| �¶�/�� | 1000 | 1115 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
��1����������Ĵ������Ĺ�����ͼ��ʾ������a��c�����Ļ�ѧ����ʽ�ɱ�ʾΪ��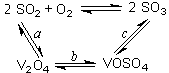
SO2+V2O5 SO3+ V2O4
SO3+ V2O4
4VOSO4+O2 2V2O5+4SO3��
2V2O5+4SO3��
�÷�Ӧ�Ĵ����� ��д��ѧʽ��
��2�� 550 ��ʱ��SO2ת��ΪSO3��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ��ʾ����2��0 mol SO2��1��0 mol O2����5 ���ܱ������У���Ӧ��ƽ�����ϵ��ѹǿΪ0��10 M Pa���Լ��㷴Ӧ2SO3 2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��
2SO2+O2��550 ��ʱ��ƽ�ⳣ��K= ��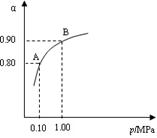
��3��550 ��ʱ����2��0 mol SO2��1��0 mol O2����5 ���ܱ������У���Ӧ ��ƽ������д�ʩ����ʹn(SO3)/n(SO2)�������
A�������¶�
B������He(g)��ʹ��ϵ��ѹǿ����
C���ٳ���2 mol SO2��1 mol O2
D���ٳ���1 mol SO2��1 mol O2
��4��ά���¶Ȳ���������ʹ֮�������·�Ӧ��2SO2��O2 2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����
2SO3������ֻ�ܱ�����A��B��A������һ�������ƶ��Ļ�����ʹ�����ڱ��ֺ�ѹ��B�����ܱ��ֺ��ݡ���ʼʱ�������������зֱ��������ʵ����������Ϊ2��1��SO2��O2�Ļ�����壬��ʹA��B�ݻ���ȣ�����ͼ��ʾ����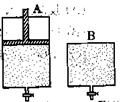
����д���пո�
A�����ﵽƽ��ʱ�����ʱ���B����__________������̻�����ƽ��ʱA������SO2��ת���ʱ�B����_______��������С�������ﵽ����ƽ���������������ͨ������ʵ�����ԭ��Ӧ���壬�ﵽƽ��ʱ��A�����Ļ��������SO3���������_________�����������С�����䡱����ͬ����B�����Ļ��������SO3���������_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com