
【题目】H2O2不稳定、易分解,Fe3+、Cu2+等对其分解起催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组同学分别设计了如图甲、乙两种实验装置。
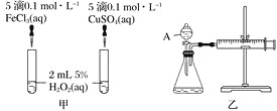
(1)若利用图甲装置,可通过观察__________现象,从而定性比较得出结论。
(2)有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是 ________。写出H2O2在二氧化锰催化作用下发生反应的化学方程式:___________。
(3)若利用乙实验可进行定量分析,图乙中仪器A的名称为________,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略,实验中还需要测量的数据是________。
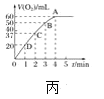
(4)将0.1molMnO2粉末加入50 mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图丙所示,解释反应速率变化的原因:________。H2O2初始物质的量浓度为_______(保留两位小数)。
【答案】产生气泡的快慢 可以消除阴离子不同对实验的干扰 2H2O2![]() 2H2O+O2↑ 分液漏斗 产生40mL气体所需的时间 随着反应的进行,反应物的浓度减小,反应速率减小 0.11 mol·L-1
2H2O+O2↑ 分液漏斗 产生40mL气体所需的时间 随着反应的进行,反应物的浓度减小,反应速率减小 0.11 mol·L-1
【解析】
(1)该反应中产生气体,可根据生成气泡的快慢判断;
故答案为:产生气泡的快慢;
(2)氯化铁和硫酸铜中阴阳离子都不同,无法判断是阴离子起作用还是阳离子起作用,硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰,在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
故答案为:可以消除阴离子不同对实验的干扰;2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)A仪器名称是分液漏斗;根据v=△c/△t知,还需要测定产生40mL气体所需的时间;
故答案为:分液漏斗;产生40mL气体所需的时间;
(4)在二氧化锰作催化剂条件下,双氧水分解生成水和氧气,反应方程式为:2H2O2![]() 2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60mLO2,则n(H2O2)=
2H2O+O2↑,浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60mLO2,则n(H2O2)=![]() ×2≈0.00536 mol,c(H2O2)=
×2≈0.00536 mol,c(H2O2)=![]() ≈0.11 mol·L-1,
≈0.11 mol·L-1,
故答案为:随着反应的进行,反应物的浓度减小,反应速率减小;0.11 mol·L-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】蔥醌(AQDS)是一种具有氧化还原活性的廉价有机分子,蔥醌/碘化铵液流可充电电池(如图)以其环保、价廉、稳定等优点被研究及广泛应用。充电时,AQDS转化为AQDS (NH4)2。 下列说法错误的是
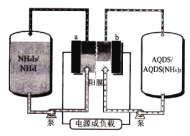
A.放电时 ,b极电势低于a极
B.充电时,a极的电极反应式为:3I--2e-= I3-
C.充电时,电路中每转移1 mole-, 膜两侧电解液的质量变化差为36 g
D.该装置中的阳膜也可以用阴膜代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中发生反应C(s)+H2O(g)![]() CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
A.断裂氢氧键速率是断裂氢氢键速率的2倍
B.混合气体平均相对分子质量不再改变
C.单位时间内消耗水与生成氢气的质量比为9∶1
D.混合气体的物质的量不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式及其叙述正确的是
A.氢气的燃烧热为285.5 kJ·mol-1,则水分解的热化学方程式为:2H2O(l)===2H2(g)+O2(g) ΔH=+285.5 kJ·mol-1
B.已知2C(石墨,s)+O2(g)===2CO(g)ΔH=-221 kJ·mol-1,则石墨的燃烧热为110.5 kJ·mol-1
C.已知N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
2NH3(g) ΔH=-92.4 kJ·mol-1,则在一定条件下将1 mol N2和3 mol H2置于一密闭容器中充分反应后,最多可放出92.4 kJ的热量
D.已知C(石墨,s)==C(金刚石,s)ΔH>0,则石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置_____________.
(2)D的最高价氧化物的水化物电子式___________,所含化学键类型____________.
(3)B、C、D、E简单离子半径由大到小顺序为_____________(用离子符号表示).
(4)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的核心内容之一是“原子经济”,即反应物的原子全部转化为所期望的最终产物,原子利用率为100%.以下制备反应中最符合“原子经济”要求的是
A.甲烷与氯气制备一氯甲烷B.![]() 与消石灰反应制取漂白粉
与消石灰反应制取漂白粉
C.铜和浓硝酸反应制取硝酸铜D.CH3C![]() CH+CO+CH3OH
CH+CO+CH3OH![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
(Ⅱ)工业上冶炼铝的流程图如图所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:

(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队报道了以LiAlCl4离子液体作为电解质的铝离子二次电池,其放电工作原理如图所示。下列说法错误的是( )
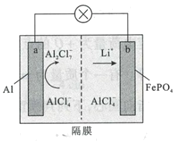
A.充电时,b极质量减小
B.放电时,阴离子向a极移动
C.充电时,正极反应为4Al2C1![]() +3e-=Al+7AlCl4
+3e-=Al+7AlCl4
D.放电时,阴极反应为FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com