

分析 先向工业废水中加过量铁,将铜全部置换出来,过滤得到固体A,其成分是铜和过量的铁,溶液B中含FeSO4和少量Na2SO4;向固体A中加入过量稀H2SO4,只有铁溶解,过滤得到固体E(铜),实现了回收金属铜,溶液F含FeSO4、H2SO4;最后溶液B和F合一块,进行蒸发,浓缩,冷却结晶,过滤,就得到FeSO4•7H2O,回收硫酸亚铁,以此解答该题.
(1)操作Ⅰ为过滤,用于分离固体和液体,用到的玻璃仪器有漏斗、玻璃棒、烧杯;
(2)加入过量的铁,铁与硫酸铜反应生成硫酸亚铁和铜,过滤得到固体A,其成分是铜和过量的铁,溶液B中含FeSO4和少量Na2SO4;
(3)加过量铁,将Cu2+全部转化为Cu,以便回收铜单质;
(4)固体A的成分是铜和过量的铁,向固体A中加入过量D为稀H2SO4,目的是将铁溶解,把铜和铁分开;
(5)从溶液B和溶液F中得到FeSO4.7H2O晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
解答 解:先向工业废水中加过量铁,将铜全部置换出来,过滤得到固体A,其成分是铜和过量的铁,溶液B中含FeSO4和少量Na2SO4;向固体A中加入过量稀H2SO4,只有铁溶解,过滤得到固体E(铜),实现了回收金属铜,溶液F含FeSO4、H2SO4;最后溶液B和F合一块,进行蒸发,浓缩,冷却结晶,过滤,就得到FeSO4•7H2O,回收硫酸亚铁,
(1)操作Ⅰ为过滤,用于分离固体和液体,用到的玻璃仪器有漏斗、玻璃棒、烧杯,
故答案为:过滤;漏斗、玻璃棒、烧杯;
(2)加入过量的铁,铁与硫酸铜反应生成硫酸亚铁和铜,过滤得到固体A,其成分是铜和过量的铁,溶液B中含FeSO4和少量Na2SO4,则溶液B中含有的离子有:Fe2+、Na+、SO42-,
故答案为:Fe、Cu;Fe2+、Na+、SO42-;
(3)加过量铁,将Cu2+全部转化为Cu,以便回收铜单质,发生的化学方程式为:Fe+CuSO4=FeSO4+Cu,
故答案为:将Cu2+全部转化为Cu,以便回收铜单质;Fe+CuSO4=FeSO4+Cu;
(4)固体A的成分是铜和过量的铁,向固体A中加入过量D为稀H2SO4,目的是将铁溶解,把铜和铁分开,发生反应的离子方程式为:2H++Fe=Fe2++H2↑,
故答案为:稀硫酸;2H++Fe=Fe2++H2↑;
(5)从溶液B和溶液F中得到FeSO4.7H2O晶体的操作为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
点评 本题考查了无机物推断及物质的分离、提纯,为高频考点,侧重于学生的分析、实验能力的考查,根据物质的性质、物质之间的反应来分析解答,难度不大,解答本题时要注意混合物的分离要考虑为彻底分开而加入过量试剂.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:HCl>H2S>PH3 | B. | 酸性强弱:H4SiO4<H2CO3<HNO3 | ||
| C. | 金属性:Na<Mg<Al | D. | 熔点:金刚石>食盐>干冰 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
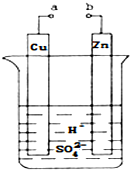 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冷凝管进出水的方向是下口进、上口出 | |
| B. | 蒸馏操作使用的温度计的水银球应插入到液体内 | |
| C. | 在蒸馏烧瓶内放入少量碎瓷片,目的是防止暴沸 | |
| D. | 蒸馏的主要仪器是蒸馏烧瓶、酒精灯、铁架台、冷凝管、锥形瓶、牛角管、温度计等 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上10月月考化学试卷(解析版) 题型:选择题
下列关于试剂存放的叙述正确的是( )

A. 浓硫酸的装运包装箱应贴上如图所示的标志
B. 金属钠保存在CCl4中(钠的密度小于CCl4)
C. 氢氧化钠溶液保存在带玻璃塞的玻璃瓶中
D. 硝酸银溶液存放在无色试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XPO4 | B. | X3PO4 | C. | X3(PO4)2 | D. | X3(PO4)4 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学b卷(解析版) 题型:填空题
完成下列表格(注明单位):
微粒 | 摩尔质量 | 质量 | 物质的量 | 微粒数 |
O | 16g/mol | 16g | ||
N2 | 0.5mol | |||
Cu | 64g/mol | 2NA | ||
H2SO4 | 1.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com