
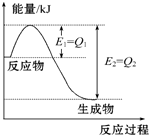
 如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1.
如图是一定的温度和压强下N2和H2反应生成1mol NH3过程中能量变化示意图,请写出工业合成氨的热化学方程式(△H的数值用含字母Q1、Q2的代数式表示):N2(g)+3H2(g)═2NH3(g)△H=2(Q1-Q2)kJ•mol-1. 科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 50 | C. | 5×103 | D. | 1×104 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
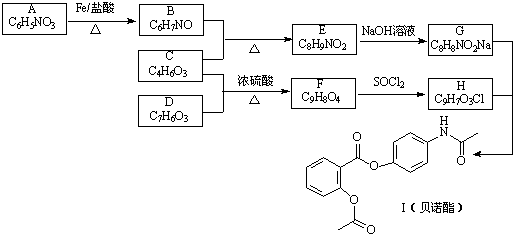
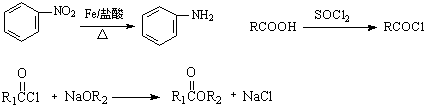
 ,G
,G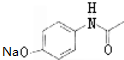 .
. .
. .
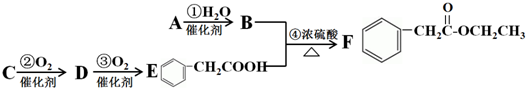
. 的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)
的合理线路(其他试剂任选,用流程图表示:写出反应物、产物及主要反应条件)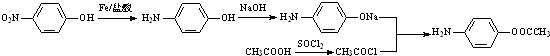 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
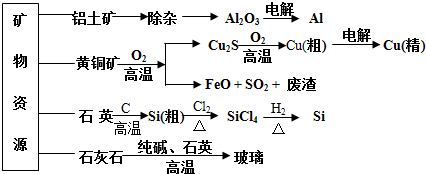
| A. | 制取玻璃的同时产生CO2气体,制取粗硅时生成的气体产物为CO | |
| B. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用作冶炼铁的原料 | |
| C. | 粗硅制高纯硅时,提纯四氯化硅可用多次蒸馏的方法 | |
| D. | 生产高纯硅、铝、铜及玻璃的过程中都涉及氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验目的 | 实验编号 | 温度 | 金属铝的形态 | 酸及浓度 |
| 1.实验①和②探究盐酸浓度对该反应速率的影响 2.实验②和③探究探究温度对反应速率的影响 3.实验②和④探究金属规格(铝片,铝粉)对该反应速率的影响 4.①和⑤实验探究铝与稀盐酸和稀硫酸反应的差异 | ① | 25℃ | 铝片 | 4.0moL/L盐酸 |
| ② | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| ③ | 35℃ | 铝片 | 2.0moL/L盐酸 | |
| ④ | 25℃ | 铝粉 | 2.0moL/L盐酸 | |
| ⑤ | 25℃ | 铝片 | 2.0moL/L硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和溶液的物质的量浓度$\frac{100a(Mr-18x)}{MrV}$ | |
| B. | 饱和溶液的质量分数$\frac{a(Mr-18x)}{(a+b)Mr}$ | |
| C. | 25℃,R的溶解度$\frac{100a(Mr-18x)}{(bMr+18ax)}$ | |
| D. | 饱和溶液的密度$\frac{a+b}{V}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素原子处于能量最低状态时,原子中共有3个未成对电子 | |
| B. | 该元素原子核外共有4个能层 | |
| C. | 该元素原子的M能层共有8个电子 | |
| D. | 该元素原子最外层共有3个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com