
【题目】根据化学常识,下列说法正确的是( )
A. 某食品包装中有一小袋干燥剂,其主要成分是CaCO3
B. 加碘食盐中的“碘”通常指碘单质
C. 农药波尔多液可以盛放在铁制容器中
D. 用完后的干电池应该回收集中处理
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS)制备钼酸钠晶体的部分流程如图1: 
(1)写出“碱浸”反应的离子方程式;
(2)减浸液结晶前需加入Ba(OH)z固体以除去SO42﹣ . 当BaMoO4开始沉淀时,SO42﹣的去除率是;[已知:碱浸液中c(MoO42﹣)=0.40molL﹣1 , c(SO42﹣)=0.04molL﹣1 , Ksp(BaSO4)=1.1×10﹣10、Ksp(BaMoO4)=4.0×10﹣8 , 加入Ba(OH)2固体引起的溶液体积变化可忽略]
(3)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因是;
(4)如图2是碳钢在3种不同介质中的腐蚀速率实验结果:
①碳钢在盐酸和硫酸中腐蚀速率随酸的浓度变化有明显差异,其原因可能是;
②空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4﹣Fe2O3保护膜.密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入NaNO2 . NaNO2的作用是;
③若缓释剂钼酸钠﹣月桂酸肌氨酸总浓度为300mgL﹣1 , 则缓蚀效果最好时钼酸钠的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种重要的有机化工原料有机物X,下面是以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去),Y是一种功能高分子材料. 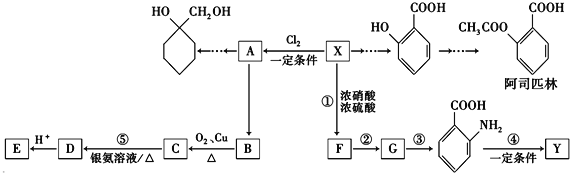
已知:
①X为芳香烃,其相对分子质量为92
②烷基苯在高锰酸钾的作用下,侧链被氧化成羧基: ![]() ③
③ ![]() (苯胺,易被氧化)
(苯胺,易被氧化)
请根据本题所给信息与所学知识回答下列问题:
(1)X的分子式为;
(2) 中官能团名称为;
中官能团名称为;
(3)反应③的反应类型是;已知A为一氯代物,则E的结构简式是;
(4)反应④的化学方程式为;
(5)阿司匹林有多种同分异构体,满足下列条件的同分异构体有种:
①含有苯环;
②既不能发生水解反应,也不能发生银镜反应;
③1mol该有机物能与2molNaHCO3完全反应.
(6)参照上述合成路线,结合所学知识,设计一条以A为原料制备 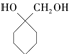 的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
的合成路线(无机试剂任用).合成路线流程图示例如下:CH3CH2OH ![]() H2C=CH2
H2C=CH2![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室一瓶固体M的标签右半部分已被腐蚀,剩余部分只看到“Na2S”字样(如图所示).已知,固体M只可能是Na2SO3、Na2SiO3、Na2SO4中的一种.若取少量固体M配成稀溶液进行有关实验,下列说法不正确的是( ) 
A.只用盐酸一种试剂就可以确定该固体M的具体成分
B.往溶液中通入二氧化碳,若有白色沉淀,则固体M为Na2SiO3
C.往溶液中加入稀硝酸酸化的BaCl2 , 若有白色沉淀,则固体M为Na2SO4
D.用pH试纸检验,若pH=7,则固体M一定是Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用一种铝铁合金为原料,模拟相关的工业生产,反应过程如图所示(部分产物和条件已略去),请回答:
(1)铁铝合金是一种高电磁性能合金,下列有关推测可能正确的是_____(填序号).
A.铁铝合金可由铁和铝熔融混合制成
B.铁铝合金的熔点高于铝和铁
C.铁铝合金硬度高于纯铝
(2)反应①中铝元素发生反应的离子方程式为 .
(3)反应②的化学方程式为 .
(4)反应③发生时观察到的现象是 .
(5)反应④中的CO2不宜换成HCl,原因是 .
(6)请分别举出固体A和B的一种用途、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境.利用钠碱循环法可脱除烟气中的SO2 .
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:;
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是;
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性,用化学平衡原理解释;
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):;
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
c.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)
(4)当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下: 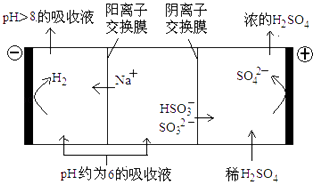
①HSO3﹣在阳极放电的电极反应式是;
②当阴极室中溶液PH升至8以上时,吸收液再生并循环利用.简述再生原理 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的种类繁多,但其命名是有规则的.下列有机物命名正确的是( )
A.![]() 2﹣乙基丁烷
2﹣乙基丁烷
B.CH3CHBr2二溴乙烷
C.![]() 2﹣甲基丁烯
2﹣甲基丁烯
D.![]() 苯甲醇
苯甲醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2的燃烧热为285.8kJmol﹣1 , S的燃烧热为296kJmol﹣1 , H2S气体燃烧热为561.7kJmol﹣1(H2S气体完全燃烧生成物是SO2和水),则硫与氢气反应的热化学方程式为 , 依据“焓判据”判定此反应是(填:“自发”或“非自发”)反应.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A.NH4HSO3与足量的2 mol/L硫酸溶液混合微热,产生的刺激性气味的气体是NH3
B.
用如图所示装置探究铜丝与过量浓硫酸的反应,为确认CuSO4生成,向①中加水,观察颜色
C.取适量铁粉与一定量的稀硝酸恰好完全反应,体现酸性的硝酸与体现氧化性的硝酸的物质的量之比为3:1
D.电解熔融氯化铝制备金属铝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com