
【题目】某化学兴趣小组欲在实验室探究氯气的性质及模拟工业制取漂白粉,设计了如下装置进行实验。
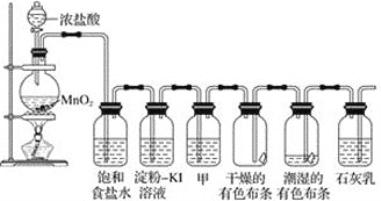
请按要求回答下列问题:
(1)饱和食盐水的作用是_______________________________;
(2)淀粉-KI溶液中观察到的现象是_____________,反应的离子方程式为_______________。
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,由该现象可得出的结论是___________________甲中盛放的试剂是____________。
(4)Cl2与石灰乳反应制取漂白粉的离子方程式为________________________;
(5)该兴趣小组用17.4 g 二氧化锰与足量的浓盐酸制备氯气,反应的离子方程为____________,理论上最多可制得标准状况下氯气的体积是_______L。
【答案】除去Cl2中混有的HCl 溶液变蓝色 Cl2+2I-=2Cl-+I2 干燥的氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性 浓硫酸 Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 4.48
Mn2++Cl2↑+2H2O 4.48
【解析】
发生装置中通过二氧化锰和浓盐酸加热反应生成氯气,氯气中含氯化氢和水蒸气,通过饱和食盐水除去氯化氢,通过淀粉碘化钾溶液变蓝,通过甲洗气瓶中的浓硫酸干燥氯气,通过干燥的有色布条不变化,通过湿润的有色布条会褪色,最后通过石灰乳反应生成漂白粉,据此解答。
(1)浓盐酸和二氧化锰加热反应生成氯化锰、氯气和水,制备的氯气中含氯化氢气体和水蒸气,通过饱和食盐水可以除去Cl2中混有的HCl;
(2)氯气氧化性强于碘,能够与碘化钾反应生成碘,碘遇到淀粉变蓝,反应的离子方程式为Cl2+2I-=2Cl-+I2;
(3)若干燥的有色布条不褪色,湿润的有色布条褪色,由于氯气与水反应生成盐酸和次氯酸,因此由该现象可得出的结论是干燥的氯气不具有漂白性,氯气与水反应生成的次氯酸具有漂白性。氯气是酸性气体,因此甲中盛放的试剂是浓硫酸,用来干燥氯气;
(4)Cl2与石灰乳反应制取漂白粉的离子方程式为Cl2+Ca(OH)2=Ca2++Cl-+ClO-+H2O;
(5)根据反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O可知反应的离子方程为MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O可知反应的离子方程为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。17.4g二氧化锰的物质的量是17.4g÷87g/mol=0.2mol,则理论上完全反应生成氯气0.2mol,标况下气体体积为0.2mol×22.4L/mol=4.48L。
Mn2++Cl2↑+2H2O。17.4g二氧化锰的物质的量是17.4g÷87g/mol=0.2mol,则理论上完全反应生成氯气0.2mol,标况下气体体积为0.2mol×22.4L/mol=4.48L。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案科目:高中化学 来源: 题型:
【题目】I.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是____;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是__________________。
(3)除去FeCl2中FeCl3中所涉及的离子方程式:________________。
II.(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是:____________,该实验证明起漂白作用的是______。(填化学式)
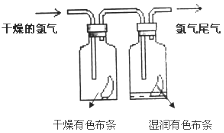
(2)①氯气有毒,实验室吸收多余的氯气的原理是(用离子方程式表示)__________________;
②根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_________(填化学式)。
③长期露置于空气中的漂白粉会失效,失效的原因是(用化学方程式表示)___________________________,________________________。
④漂白粉是否完全失效可用稀盐酸检验,加稀盐酸后产生的气体是______(填字母代号)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
D. 现代化学分析中,可采用质谱法来确定有机物分子中的官能团
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与科学、技术、社会、环境密切相关.下列有关说法中错误的是( )
A. 节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩
B. 为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶
C. 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂
D. 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以0.100 0 mol·L-1 NaOH溶液滴定c mol·L-1某弱酸HA溶液,其滴定曲线如图所示。下列说法正确的是
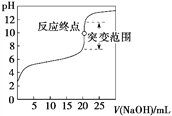
A. 可用甲基橙作滴定指示剂(已知甲基橙的变色范围为3.1~4.4,pH<3.1时溶液为红色,pH>4.4时溶液为黄色)
B. 指示剂指示的滴定终点就是反应终点
C. 突变范围的大小与酸的强弱及酸的浓度有关
D. 滴定时氢氧化钠溶液盛放在带活塞的滴定管中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于碱金属元素的下列叙述中,错误的是( )
A.碱金属元素原子最外层都只有1个电子
B.随电子层数增加,原子半径增大,金属还原性增强
C.随核电荷数递增,氢氧化物碱性增强
D.Li、Na、K、Rb、Cs,单质熔沸点升高,密度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为______molL-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是______。
A.溶液中HCl的物质的量 B.溶液的浓度 C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.400molL-1的稀盐酸。
①该学生需要量取______mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在括号内填A表示“偏大”、填B表示“偏小”、填C表示“无影响”)。
a.用量筒量取浓盐酸时俯视观察凹液面______。
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水______。
(4)假设该同学成功配制了0.400molL-1的盐酸,他又用该盐酸中和含0.4g NaOH的NaOH溶液,则该同学需取______mL盐酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ | ⑩ |
(1)表中化学性质最不活泼的元素,其原子结构示意图为 ________ ;
(2)表中能形成两性氢氧化物的元素是 ________ (用元素符号表示),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式:_________;
(3)③⑦⑩三种元素的阴离子还原性顺序为: ___________________;⑦的水溶液呈__________色 ;
(4)①、②、⑥、⑦四种元素的最高价氧化物的水化物中酸性最强的是 _______(填化学式) ;
(5)③元素与⑩元素两者核电荷数之差是 ____________ ;
(6)设计实验方案:比较⑦与⑥单质氧化性的强弱,请将方案填入下表。
实验步骤 | 实验现象与结论 |
____________________ | ____________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com