
(1)配平可逆反应:![]()
已知400℃时,1.6 mol NO和NH3混合气体发生以上反应达到平衡后,混合气体的物质的量变为1.7 mol,则被氧化的N的物质的量为 。
(2)已知某温度下0.01 mol/L盐酸溶液中水电离的c(H+)=l x 10-11mol/L,则Kw= ;若在此温度下将pH==a的NaOH溶液与pH=b的盐酸按1:100体积刚好完全反应,a、b应满足关系为 。
(3)有一种白色固体,可能含有CaCO3、Ba(N O3)2、NH4 C1、KCl、A gN O3、Al2(SO4)3
和KMnO4中的一种或几种。①将白色固体用水溶解并过滤,②将滤渣加入足量盐酸中,滤渣全部溶解并放出气体;③向滤液中加入足量浓NaOH溶液,加热,放出能使湿润红色石蕊试纸变蓝的气体,待溶液冷却后,继续滴入适量的稀盐酸,有白色沉淀产生。则该白色固体中一定有 ,可能有 。
本题考查氧化还原反应的配平及计算、有关溶液pH计算和物质的检验。
(1)该反应是氧化还原反应,可用得失电子法配平,6NO+4NH3![]() 5N2+6H2O,按化学平衡方程式计算:6NO+4NH3
5N2+6H2O,按化学平衡方程式计算:6NO+4NH3![]() 5N2+6H2O △n
5N2+6H2O △n
6 4 1
x y 1.7 mol-1.6 mol= 0.1mol
解得:x=0.6 mol y=0.4 mol,NH3被氧化,则被氧化的N的物质的量为0.4 mol。
(2)在水溶液中,水电离H2O![]() H++OH-,故c(H+)水=c(OH-)水=lx10-11mol/L,c(OH-)aq=c(OH-)水=lx10-11mol/L,c(H+)aq= c(HCl)= 0.01 mol/L,Kw= c(H+)aq ×c(OH-)aq= 0.01×lx10-11= l x10-13;pH=a的NaOH溶液中c(OH-)=lx10-13/10-a=10 a -13mol/L,pH=b的盐酸中c(H+)=10 -bmol/L,据H++OH-=H2O,则10 -bmol/L×100=10 a -13mol/L×1,得a+b=11。
H++OH-,故c(H+)水=c(OH-)水=lx10-11mol/L,c(OH-)aq=c(OH-)水=lx10-11mol/L,c(H+)aq= c(HCl)= 0.01 mol/L,Kw= c(H+)aq ×c(OH-)aq= 0.01×lx10-11= l x10-13;pH=a的NaOH溶液中c(OH-)=lx10-13/10-a=10 a -13mol/L,pH=b的盐酸中c(H+)=10 -bmol/L,据H++OH-=H2O,则10 -bmol/L×100=10 a -13mol/L×1,得a+b=11。
(3) 由①可知没有KMnO4(紫色)存在,由②可知有CaCO3存在,由③可知有NH4 C1、Al2(SO4)3存在,由于NH4 C1、Al2(SO4)3存在,则Ba(N O3)2 、A gN O3不能存在(会与前者产生沉淀,不溶解于足量盐酸)。故一定有CaCO3、NH4 C1、Al2(SO4)3存在,可能有KCl。


科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
I.科学家一直致力于“人工固氮”的新方法研究。
(l)目前合成氨技术原理为:![]() △
△![]()
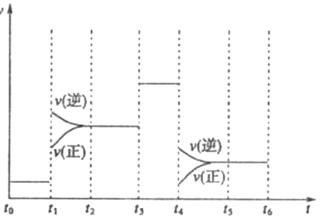 下图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
下图表示工业合成氨反应在某一段时间中反应速率与反应过程的关系曲线图:
①氢化物的体积分数最高的一段时间为 ;![]() 时刻改变的反应条件是 。
时刻改变的反应条件是 。
②![]() 极易溶于水,其水溶液俗称氨水。用水稀释
极易溶于水,其水溶液俗称氨水。用水稀释![]() 的氨水,溶液中随着水量的增加而减小的是 (填序号)。
的氨水,溶液中随着水量的增加而减小的是 (填序号)。
![]()
![]()
![]()
![]()
(2)1998年希腊亚里士多德大学的两位科学家采用高质子导电性的SCY冉瓷(能传递![]() ),实现了高温常压下利用
),实现了高温常压下利用![]() 和
和![]() 电解合成氨。其阴极的电极反应式 。
电解合成氨。其阴极的电极反应式 。
(3)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,![]() 在催化剂(掺有少量
在催化剂(掺有少量![]() 的
的![]() )表面与水发生下列反应:
)表面与水发生下列反应:
![]() △
△![]() 进一步研究
进一步研究![]() 生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表
| 303 | 313 | 323 |
| 4.8 | 5.9 | 6.0 |
①此合成反应的![]() 0,△
0,△![]() 0,(填“>”“<”或“=”)。
0,(填“>”“<”或“=”)。
②已知:![]() △
△![]() ;
;
![]() △
△![]()
则![]() △
△![]() = 。
= 。
II.已知可逆反应![]() (未配平)△
(未配平)△![]() 。温度为
。温度为![]() 时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图
时,在容积固定的容器中发生反应,各物质的浓度随时间变化的关系如图![]() 所示。
所示。
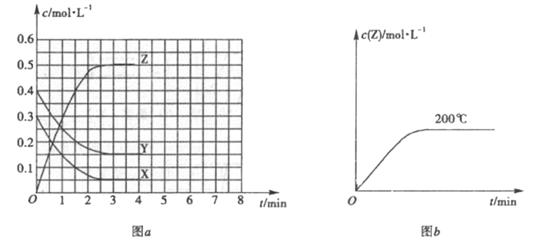
(1)![]() ℃时,该反应的平衡常数为
℃时,该反应的平衡常数为
(2)图![]() 为200℃时容器内
为200℃时容器内![]() 的变化曲线,请在图中补画该反应在100℃时的
的变化曲线,请在图中补画该反应在100℃时的![]() 的
的
变化曲线。
查看答案和解析>>
科目:高中化学 来源:2010年山东省聊城市高考化学二模试卷(解析版) 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com