
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、[Al(OH)4]- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、Al3+ | 少量HCl | H++HCO3-═CO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫少量,氢离子与次氯酸根离子结合生成次氯酸;
B.四种离子之间能够共存,且铁离子具有强氧化性,能够氧化硫化氢;
C.铁离子、铵根离子与[Al(OH)4]-反应;
D.碳酸氢根离子与铝离子发生双水解反应.
解答 解:A.二氧化硫少量时,反应产物中的氢离子与次氯酸根离子反应生成HClO,正确的离子方程式为:SO2+3ClO-+H2O═SO42-+Cl-+2HClO,故A错误;
B.NH4+、Fe3+、Br-、SO42-之间不反应,加入过量H2S后发生反应:2Fe3++H2S═2Fe2++S↓+2H+,故B正确;
C.NH4+、Fe3+与[Al(OH)4]-发生反应,在溶液中不能大量共存,故C错误;
D.HCO3-、Al3+之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存、离子方程式的判断,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;要求学生熟练掌握离子方程式的书写原则.


科目:高中化学 来源: 题型:选择题
| A. | 硬铝的密度约为钢材的三分之一,是适合于做飞行器的材料 | |
| B. | 硬铝的强度比铝大得多,铝材比钢材的某些性能要好 | |
| C. | 硬铝的熔点跟铝相比有一定的提高,常被用于炊具 | |
| D. | 硬铝的抗腐蚀性较强,常被用于制门窗框架 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 室温下,浓度均为0.1 mol•L-1Na2S2O3和H2SO4溶液,各取5 mL、10 mL的Na2S2O3溶液分别与10 mL的H2SO4溶液混合反应,验证Na2S2O3浓度对反应速率的影响 | |
| B. | 通过测定室温下等浓度的HNO3和H2SO4溶液的pH值,比较元素N、S的非金属性强弱 | |
| C. | KI--I2溶液中存在如下平衡:I2+I-?I3-.取V1mI平衡混合溶液,滴加几滴淀粉,用c mol/L的Na2S2O3溶液进行滴定(反应为I2+2Na2S2O3=2NaI+Na2S4O6),滴定终点时消耗V2 mL的Na2S2O3溶液.根据V1、V2和c可测定上述平衡体系中c(I2) | |
| D. | 确定铝片中氧化铝的含量:取一定质量的铝片,与过量的NaOH溶液充分反应,溢出的气体通过硅胶后,冷却至室温后准确测量其体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜,当外电路通过NA个电子时;阳极质量减少32 g | |
| B. | 反应3H2(g)+N2(g)?2NH3(g)△H=-92kJ•mol-1,当放出热量 9.2 kJ时,转移电子0.6 NA | |
| C. | lmol•L1的氯化铜溶液中,若Cl-的数目为2Na,则Cu2+的数目为NA | |
| D. | 标准状况下,NO和O2各11.2L混合充分反应,所得气体的分子总数为0.75 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化铝溶液蒸干后灼烧得不到无水氯化铝 | |
| B. | 氯化铁溶液常用作制印刷电路板的腐蚀剂 | |
| C. | 常用热的纯碱溶液除去油污 | |
| D. | 长期施用硫酸铵易使土壤酸化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物是SO42- | |
| B. | 氧化剂与还原剂的物质的量之比是1:3 | |
| C. | Cr2O72-表现了氧化性 | |
| D. | 还原1molCr2O72-,电子转移3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H2SO4 | |
| B. | Na、Mg与水反应,Na更剧烈 | |
| C. | 气态氢化物的稳定性:HF>HCl | |
| D. | 向Na2SO3溶液中加盐酸,有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
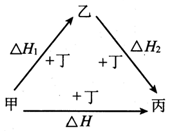 甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )
甲、乙、丙、丁四种物质在一 定条件下的转化关系如图所示,当乙作为反应物且与甲的物质的量相等时,△H=△H1+△H2.则甲、丙可能是( )| A. | S、SO3 | B. | AlCl3、NaAlO2 | C. | Na、Na2O2 | D. | NaOH、Na2CO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com