
| A. | 4.4 g | B. | 2.2 g | C. | 5.5 g | D. | 8.2 g |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:

已知碳的燃烧热△H1=akJ·mol—1
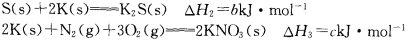
则x为
A.a+b-c B.c+3a-b C.3a+b-c D.c+a-b
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
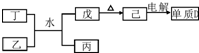
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 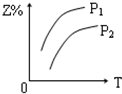 | B. | 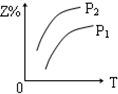 | C. | 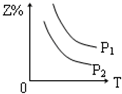 | D. | 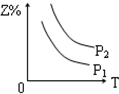 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)═2H2O(g)△H1 2H2(g)+O2(g)═2H2O(l)△H2 | |
| B. | S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H1 C(s)+O2(g)═CO2(g)△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g)△H1 $\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g)△H2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com