
【题目】下图①—⑩分别代表有关反应中的一种物质,其中③气体能使酚酞试液变红,⑦是红综色气体,回答:

(1)①中的混合气体通过浓硫酸发生化学反应,主要生成物的化学式是____。
(2)写出碳酸氢铵中阳离子的检验方法______________________________。
(3)写出工业上合成③的化学方程式__________________________________。
(4)⑧与⑨反应的化学方程式是______________________________________。
【答案】(NH4)2SO4 取少量样品放入试管配成溶液,加入浓的氢氧化钠溶液微热,在试管口放一片湿润的红色石蕊试纸,若试纸变蓝则含有氨根离子 N2+ 3H2![]() 2NH3 C + 4HNO3(浓)
2NH3 C + 4HNO3(浓)![]() CO2↑+ 4NO2↑ + 2 H2O
CO2↑+ 4NO2↑ + 2 H2O
【解析】
碳酸氢铵反应得到混合气体①为CO2、NH3,通过碱石灰得到③为NH3,混合气体通过浓硫酸得到②为CO2,二氧化碳与过氧化钠反应生成碳酸钠与氧气,其中④能与氨气反应,可推知④为O2,⑤为Na2CO3,氨气与氧气反应生成⑥为NO,进一步与氧气反应生成⑦为NO2,NO2与水反应生成NO与⑧,则⑧为HNO3,二氧化碳与Mg反应生成C与MgO,C与浓硝酸反应生成二氧化碳、二氧化氮与水,据此解答。
根据上述分析可知,
(1)碳酸氢铵分解的气体产物有氨气、二氧化碳、水,氨气被硫酸吸收主要得硫酸铵,化学式为(NH4)2SO4
(2)碳酸氢铵中的阳离子是铵根离子,其检验方法为取少量样品放入试管配成溶液,加入浓的氢氧化钠溶液微热,在试管口放一片湿润的红色石蕊试纸,若试纸变蓝则含有氨根离子。
(3)碳酸氢铵的分解产物被碱石灰吸收后余氨气,所以工业上合成氨气的化学方程式N2+ 3H2![]() 2NH3
2NH3
(4)⑦是二氧化氮,则⑧是硝酸;①的混合气体产物被浓硫酸吸收后余二氧化碳,二氧化碳与镁反应生成碳单质,所以⑧与⑨反应是碳和浓硝酸的反应,化学方程式为C + 4HNO3(浓)![]() CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O


科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液
D. 滤液加稀盐酸时只发生反应:H+ +OH- =H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中几种常见物质的转化关系如图所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。
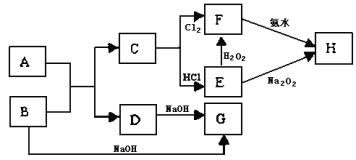
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围____;
(2)写出H2O2的电子式:____;
(3)写出B→G的离子方程式____;
(4)若A、B恰好完全反应,将产物C与足量盐酸反应得到amol气体,另取等质量B与足量盐酸反应得到b mol气体,a:b=5:7,则A的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石[主要成分为CuCO3·Cu(OH)2、CuSiO3·2H2O,含SiO2、FeCO3、Fe2O3等杂质]为原料制备CuCl2的工艺流程如下:

已知: SOCl2+H2O![]() SO2↑+2HCl↑,下列说法不正确的是
SO2↑+2HCl↑,下列说法不正确的是
A. “酸浸” 时应该用盐酸溶解硅孔雀石粉
B. “氧化”时发生反应的离子方程式为:Cl2+2Fe2+![]() 2Fe3++2Cl-
2Fe3++2Cl-
C. “调pH”时,pH需控制在碱性区域,保证铁元素全部以Fe(OH)3形式除去
D. “加热脱水”时,加入SOCl2的目的是生成的HCl抑制CuCl2的水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH3是重要的化工原料。
(1)工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),对生态环境和人类健康带来较大的威胁。工业上可用氨催化吸收法处理NOx,反应原理为:4x NH3 + 6NOx![]() (2 x + 3)N2 + 6x H2O
(2 x + 3)N2 + 6x H2O
某化学兴趣小组模拟该处理过程的实验装置如下(夹持装置已略去):
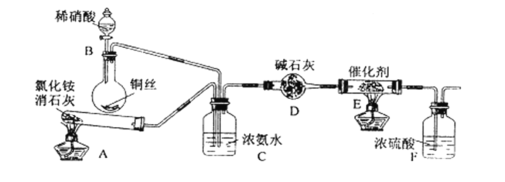
①装置A中发生反应的化学方程式为____________________。
②装置B中发生反应的化学方程式为____________________。
③装置D中碱石灰的作用是__________________________。
(2)按下图装置进行NH3性质实验。

①先打开旋塞1,B瓶中的现象是_________________________________,稳定后,关闭旋塞1。
②再打开旋塞2,B瓶中的现象是_________________。
(3)下图是甲同学设计收集氨气的几种装置,其中可行的是________,集气的原理是________。
a. ![]() b.
b.  c.
c.  d.
d. 
(4)为防止污染环境,以下装置(盛放的液体均为水)可用于吸收多余氨气的是________(填序号)。
①.  ②.
②.  ③.
③. 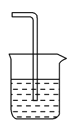 ④.
④. 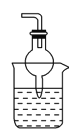
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组的同学欲测定该补血剂中铁元素的含量。实验步骤如下:
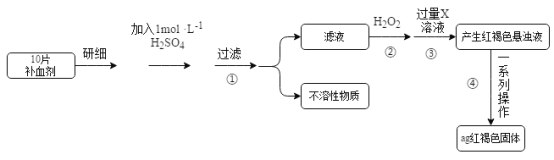
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是取样,先滴加KSCN溶液,再滴加_____,该过程的现象为________。
(2)步骤②加入过量H2O2的目的是________。
(3)步骤③中反应的离子方程式是_________。
(4)步骤④中一系列处理的操作步骤:过滤、_____、灼烧、冷却、称量。
(5)若实验中铁无损耗,则每片补血剂中含铁元素的质量为_______g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某种有机物分子的球棍模型图,图中的“棍”代表单键或双键,不同大小的“球”代表不同的短周期元素的原子,对该有机物的叙述不正确的是
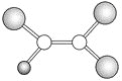
A. 该有机物可能的化学式为C2HCl3
B. 该有机物可以由乙烯和氯化氢通过加成反应得到
C. 该有机物分子中的所有原子在一个平面上
D. 该有机物分子中一定有碳碳双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是与生命活动密切相关的三种常见化合物,每种物质所含元素种类均不超过三种,甲是单质。它们之间有如下转化关系:
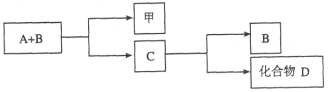
化合物D也是生活中常见的化合物,在一定条件下可发生如下反应:D+3甲![]() 3A+2B
3A+2B
请回答下列问题:
(1)在化合物A、B、C、D中所含元素完全相同的是__________和__________(填字母)。
(2)在常温下,A和B通过__________转化为C。该过程的能量转化关系如何?
____________________。
(3)写出由C生成D的反应的化学方程式____________________。
(4)化合物C是人类生命活动不可缺少的物质之一,它在血液中的正常含量是__________。
(5)目前化合物B在大气中含量呈上升趋势,对环境造成的影响是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为______________________________;
(2)写出与H2O分子互为等电子体的微粒_________________________(填2种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是______________
A.氧原子的杂化类型发生了改变 | B.微粒的形状发生了改变 |
C.微粒的化学性质发生了改变 | D.微粒中的键角发生了改变 |
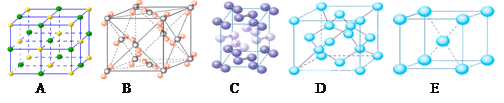
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_________(请用相应的编号填写)
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能” 是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配离子。请写出生成此配离子的离子方程式:__________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com