
【题目】中和滴定是实验室定量测定未知酸或碱浓度的重要方法。25℃时,向 20.00 mL NaOH溶液中逐滴滴入某浓度的CH3COOH溶液以测定该醋酸溶液的浓度。滴定过程中,溶液的pH与滴入CH3COOH 溶液的体积关系如图所示, 回答下列问题:
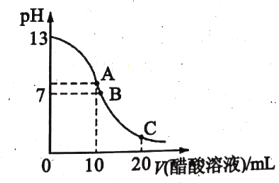
(1)滴定时,使用到的主要玻璃仪器有__________。
(2)选择的指示剂是_________,如何判断滴定达到终点 _____________。
(3)若当滴定达到终点时,测得消耗 CH3COOH 溶液的体积为 10.00 mL. 则所测醋酸溶液的浓度为 _________molL-1。
(4)图中B 点所示溶液中c(Na +)______c(CH3COO-)(填“>”“<”或“=”)。
(5)图中 C 点对应的pH=4.7,该点所示溶液中c(CH3COO-)+ c(OH-)-c(Na+)=________ molL-1(已知:lg2=0.3)。
【答案】酸式滴定管、锥形瓶、碱式滴定管 酚酞 滴入最后一滴醋酸溶液振荡,溶液由红色变成浅红色,且半分钟内不恢复红色 0.20 = 2.0×105
【解析】
中和滴定使用到的主要玻璃仪器有酸式滴定管、碱式滴定管、锥形瓶;根据滴定终点的酸碱性选择指示剂;根据滴定曲线的起点确定氢氧化钠标准溶液的浓度,并根据其消耗量计算醋酸的物质的量浓度;根据电荷守恒确定相关离子浓度之间的关系。
(1)滴定时,使用到的主要玻璃仪器有酸式滴定管、锥形瓶、碱式滴定管。
(2)滴定终点得到的醋酸钠溶液显碱性,酚酞的变色范围是8.2~10.0,故可选择酚酞作指示剂,滴定达到终点的判断方法是:滴入最后一滴醋酸溶液振荡,溶液由红色变成浅红色,且半分钟内不恢复红色。
(3)由滴定曲线的起点可知,所用标准碱液的pH=13、体积为20.00 mL,则c(NaOH)=0.10mol/L,滴定达到终点时,测得消耗CH3COOH溶液的体积为 10.00 mL,则所测醋酸溶液的浓度为![]() 0.20molL-1。
0.20molL-1。
(4)图中B 点所示溶液中pH=7,溶液显中性,c(OH-)=c(H+),根据电荷守恒c(Na +)+ c(H+)= c(OH-) +c(CH3COO-)可知,c(Na +)=c(CH3COO-)。
(5)图中 C 点对应的pH=4.7,则c(H+)=10-4.7mol/L=2.0×105molL-1,根据电荷守恒c(Na +)+ c(H+)= c(OH-) +c(CH3COO-)可知,该点所示溶液中c(CH3COO-)+c(OH-)-c(Na+)= c(H+)=2.0×105molL-1。


科目:高中化学 来源: 题型:
【题目】已知I-、Fe2+、SO2、Cl-和H2O2均有还原性,它们在酸性溶液中还原性的顺序为SO2>I->Fe2+>H2O2>Cl-,则下列反应不可能发生的是
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关。下列说法错误的是 ( )
A.疫苗一般应冷藏存放,以避免蛋白质变性
B.医用口罩无纺布的原材料成分之一是聚丙烯,其结构简式为![]()
C.使用医用酒精杀菌消毒的过程中只发生了物理变化
D.医用防护服的核心材料是微孔聚四氟乙烯薄膜,其单体四氟乙烯属于卤代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.除去FeSO4 溶液中的 Fe3+, 可向溶液中加入铜粉, 通过反应 Cu + 2Fe3+ = Cu2+ + 2Fe2+除去 Fe3+
B.常温下,pH为5的 NH4Cl 溶液和pH为5的稀盐酸中,水的电离程度相同
C.由于存在水的电离,0.1 molL-1 的 H2C2O4溶液中, c(H+)/c(C2O![]() )略大于2
)略大于2
D.向氨水中滴加等浓度的盐酸溶液,滴加过程中,c(NH![]() )先增大后减小
)先增大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL 0.2molL-1 的MOH中逐滴加入0.2 molL-1的CH3COOH溶液,溶液的导电能力如图1所示,溶液的pH 变化如图2所示(已知:常温时,NH3H2O和CH3COOH的电离常数均为1.8×10-5), 下列说法正确的是
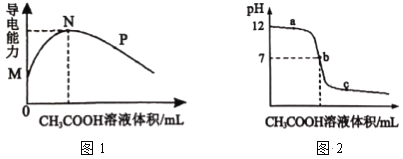
A.图l中N点时,加入CH3COOH溶液的体积为l 0 mL
B.MOH是一种弱碱,相同条件下其碱性弱于 NH3H2O 的碱性
C.图2中b点时,加入CH3COOH溶液的体积为l 0 mL
D.若c点对应醋酸的体积是15 mL,则此时溶液中:c(CH3COOH) + c(CH3COO-) < 0.1 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 1 mol苯甲酸在浓H2SO4存在下与足量乙醇反应可得1 mol苯甲酸乙酯
B. 对苯二甲酸(![]() )与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维(
)与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维(![]() )
)
C. 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种
D. ![]() 分子中的所有原子有可能共平面
分子中的所有原子有可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究外界条件对反应:mA(g)+nB(g)cZ(g) ΔH 的影响,以A和B物质的量之比为m:n开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示.下列判断正确的是 ( )
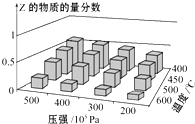
A.在恒温恒压条件下,向已达到平衡的体系中加入少量Z,达新平衡时,Z的物质的量分数不变
B.升高温度,正、逆反应速率都增大,平衡常数增大
C.ΔH>0,m+n>c
D.温度不变,增大压强,平衡正向移动,达新平衡时,A的浓度比原平衡减小
查看答案和解析>>
科目:高中化学 来源: 题型:
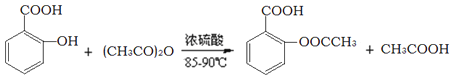
【题目】阿司匹林的有效成分是乙酰水杨酸(![]() )。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
)。实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成乙酰水杨酸,制备的主要反应为:
操作流程如下:

已知:水杨酸和乙酰水杨酸均微溶于水,但其钠盐易溶于水,醋酸酐遇水分解生成醋酸。
回答下列问题:
(1)合成过程中最合适的加热方法是______________。
(2)提纯粗产品流程如下,加热回流装置如图:
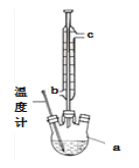
①沸石的作用是_______________;
②冷凝水的流出方向是____________(填“b”或“c”);
③使用温度计的目的是____________。
(3)检验最终产品中是否含有水杨酸的化学方法是_________________。
(4)阿司匹林药片中乙酰水杨酸含量的测定步骤(假定只含乙酰水杨酸和辅料,辅料不参与反应):
Ⅰ.称取阿司匹林样品m g;Ⅱ.将样品研碎,溶于V1 mL a mol·L-1NaOH(过量)并加热,除去辅料等不溶物,将所得溶液移入锥形瓶;Ⅲ.向锥形瓶中滴加几滴酚酞,用浓度为b mol·L-1的标准盐酸到滴定剩余的NaOH,消耗盐酸的体积为V2mL。
① 写出乙酰水杨酸与过量NaOH溶液加热发生反应的化学方程式______________。
② 阿司匹林药片中乙酰水杨酸质量分数的表达式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,密闭容器中发生反应4A(s)+3B(g)2C(g)+D(g),经2 min B的浓度减少0.6 molL-1,对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 molL-1min-1
B.2min末的反应速率v(C)=0.2 molL-1min-1
C.2min内D的物质的量增加0.2mol
D.若起始时A、B的物质的量之比为4∶3,则2 min末A、B的转化率之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com