


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该电池正极反应式为:MnO2+H2O+e-=MnOOH+OH- |
| B、电池工作时负极pH一定降低 |
| C、用该电池作电源精炼铜,纯铜与锌连接 |
| D、用该电池作电源电解硫酸铜溶液,负极溶解6.5g锌,阴极一定析出6.4g铜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、足量的硫单质与64g铜反应,有2mol电子发生转移 |
| B、常温下,向AgCl悬浊液中加入少量NaCl固体后振荡,Kap(AgCl)增大 |
| C、0.1mol?L-1Na2CO3中加入少量NaOH固体振荡,c(Na+)和c(CO32-)都增大 |
| D、相同浓度的CH2COOH和CH2COONa溶液等体积混合后,则:c(CH2COO-)+c(CH2COOH)=c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和Ca(HCO3)2溶液中加入足量的NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| B、次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| C、1 L 2 mol?L-1的FeBr2溶液中通入2.5 mol Cl2:4Fe2++6Br-+5Cl2═10Cl-+4Fe3++3Br2 |
| D、在H2C2O4中加入酸性KMnO4溶液:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNaOH的摩尔质量为40g |
| B、1mol 物质含有的微粒数就是6.02×1023 |
| C、1molN2的体积为22.4L |
| D、0.5molCO2约含有3.01×1023个CO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 水 |
| 酒化酶 |
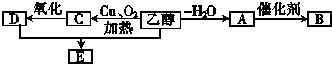
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com