
| A. | 反应①为放热反应 | B. | 增大反应①的压强,H2转化率提高 | ||
| C. | 反应②使用催化剂,△H2不变 | D. | △H3=-58 KJ•mol-1 |
分析 A.△H>0的反应为吸热反应;
B.反应①中,反应前后气体的体积不变;
C.加入催化剂,不改变反应热;
D.由盖斯定律将①+②可得CO2(g)+3H2(g)?CH3OH(g)+H2O(g),气体变为液体放出热量.
解答 解:A.反应①的△H>0,为吸热反应,故A错误;
B.反应①中,反应前后气体的体积不变,则增大压强,平衡不移动,氢气的转化率不变,故B错误;
C.加入催化剂,可降低反应的活化能,但不改变反应热,故C正确;
D.由盖斯定律将①+②可得CO2(g)+3H2(g)?CH3OH(g)+H2O(g),△H=-58 KJ•mol-1,气体变为液体放出热量,则CO2(g)+3H2(g)?CH3OH(g)+H2O(l)△H3<-58 KJ•mol-1,故D错误.
故选C.
点评 本题考查化学反应与能量变化,为高频考点,侧重考查学生的分析能力,主要把握盖斯定律的运用,理解外界条件对平衡移动的影响,难度不大.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:解答题
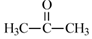 )分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.
)分子中碳原子轨道的杂化类型是sp2和sp3,1mol 丙酮分子中含有σ键的数目为9NA.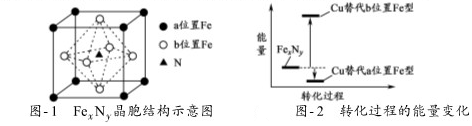
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W和Z形成的化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | X的单质可由金属单质置换得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入的物质 | 结论 | |
| A | 0.05molCH3COONa固体 | $\frac{c(C{H}_{3}CO{O}^{-})}{c(N{a}^{+})}$减小 |
| B | 0.05molNaHSO4固体 | C(CH3COO-)+c(CH3COOH)=c(Na+)-c(SO42-) |
| C | 0.05molNH4Cl固体 | 水电离程度增大 |
| D | 50mLH2O | 由水电离出的c(H+)c(OH-)减小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Y<Z<W | |
| B. | X分別与Z、W形成的化合物中,所含化学键类型相同 | |
| C. | X、Y形成的最简单化合物的电子式为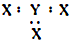 | |
| D. | Z分別与X、W均可形成具有漂白性的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
| A. | T1>T2,且a>0 | |
| B. | 当温度为T2、反应进行到40 min时,x>0.15 | |
| C. | 温度为T2时,若向平衡后的容器中再充入0.50 mol CH4和1.2mol NO2,重新达到平衡时,n(N2)=0.70mol | |
| D. | 温度为T1时,达平衡时CH4 的转化率大于NO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 产物C2所具有的总能量高于反应物A2和B2所具有的总能量 | |
| B. | 反应物A2和B2所具有的总能量高于产物C2所具有的总能量 | |
| C. | 破坏A2和B2分子内的化学键所吸收的总能量高于形成C2分子内的化学键所放出的总能量 | |
| D. | 破坏A2和B2分子内的化学键所放出的总能量高于形成C2分子内的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
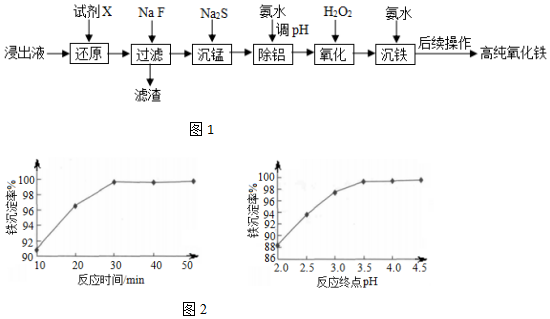
| 氢氧化物 | Fe3+ | Fe2+ | Al3+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 |
| 沉淀完全的pH | 3.2 | 8.8 | 5.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com