
| A. | NaAlO2溶液中通入过量的CO2:AlO2-+CO2+2H2O=Al(OH)3↓+CO32- | |
| B. | NO2溶于水:3NO2+H2O=2H+$_{\;}^+$+2NO3-+NO | |
| C. | 醋酸溶液与水垢中的Mg(OH)2反应:Mg(OH)2+2H+═Mg2++2H2O | |
| D. | NaClO溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
分析 A.二氧化碳过量,反应生成氢氧化铝和碳酸氢钠;
B.二氧化氮与水反应生成硝酸和一氧化氮;
C.醋酸为弱酸,应保留化学式;
D.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
解答 解:A.反应生成氢氧化铝和碳酸氢钠,离子反应为:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故A错误;
B.NO2溶于水,反应生成硝酸和一氧化氮,离子方程式:3NO2+H2O=2H+$_{\;}^+$+2NO3-+NO,故B正确;
C.醋酸溶液与水垢中的Mg(OH)2反应,离子方程式:Mg(OH)2+2CH3COOH═Mg2++2H2O+2CH3COO-,故C错误;
D.NaClO溶液中通入过量SO2气体的离子反应为ClO-+H2O+SO2═2H++Cl-+SO42-,故D错误;
故选:B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应、水解反应的离子反应的考查,注意化学式的拆分,题目难度不大.


科目:高中化学 来源: 题型:解答题
 甲烷可用氧化铁作催化剂实现选择性地催化脱硝.
甲烷可用氧化铁作催化剂实现选择性地催化脱硝.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
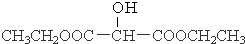 .
.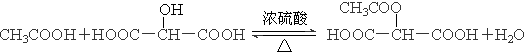 .
.
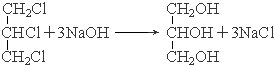 .
.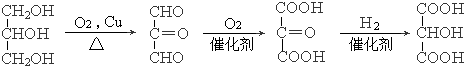 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 将过量SO2通入冷氨水中:SO2+NH3•H2O=HSO3-+NH4+ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
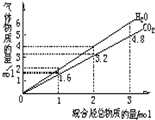 两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )
两种气态烃组成的混合气体完全燃烧后所得CO2和H2O的物质的量随混合烃总物质的量变化如图所示,则下列对混合烃的判断正确的是( )| A. | 一定含有甲烷 | B. | 一定含有乙烯 | C. | 一定含有丙炔 | D. | 一定不含乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯的硝化反应中,向浓硫酸中加浓硝酸制得混合酸 | |
| B. | 向稀氨水中逐渐加入硝酸银溶液来配制银氨溶液 | |
| C. | 向相对过量的氢氧化钠溶液中滴入少量硫酸铜溶液以配制新制氢氧化铜 | |
| D. | 溴乙烷在氢氧化钠溶液的存在下进行水解后,加入硝酸银溶液,可检验溴离子的存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
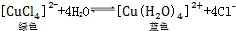 .下列措施:①加锌粉 ②加蒸馏水 ③通入HCl气体 ④浓缩.能使呈蓝色的CuCl2溶液变为绿色的是( )
.下列措施:①加锌粉 ②加蒸馏水 ③通入HCl气体 ④浓缩.能使呈蓝色的CuCl2溶液变为绿色的是( )| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2的值不能确定 | |
| B. | 平衡时,Y和Z的生成速率之比为1:1 | |
| C. | 0.48mol•L-1<c1+c2+c3<0.56mol•L-1 | |
| D. | c1的取值范围为0<c1<0.14 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com