
下列有关说法中,不正确的是( )
|
| A. | a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a一定小于b |
|
| B. | 常温,CH3COONa溶液的pH=8,则c(Na+)﹣c(CH3COO﹣)=9.9×10﹣7mol/L |
|
| C. | 常温下,0.1mol/L的某酸溶液中,若c(OH﹣)/c(H+)=1×10﹣8,则溶液中由水电离出的c(H+)=1×10﹣11mol/L |
|
| D. | 在0.1mol/L的Na2SO3溶液中加入少量NaOH固体,c(SO32﹣)与c(Na+)均增大 |
| 酸碱混合时的定性判断及有关ph的计算;盐类水解的应用. | |
| 专题: | 电离平衡与溶液的pH专题;盐类的水解专题. |
| 分析: | A、HCN为弱电解质,a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,若a=b,生成NaCN溶液,c(Na+)>c(CN﹣),若a<b,也能满足c(Na+)>c(CN﹣),所以满足关系为a≤b; B、根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣),则c(Na+)﹣c(CH3COO﹣)=c(OH﹣)﹣c(H+); C、常温下,c(OH﹣)/c(H+)=1×10﹣8,根据Kw=c(OH﹣)•c(H+)=1×10﹣14,可得,c(H+)=1×10﹣3mol/L,酸性溶液中氢氧根离子是水电离的,据此计算出水电离的氢离子; D、亚硫酸钠溶液中,亚硫酸根离子存在水解平衡:SO32﹣+H2O⇌HSO3﹣+OH﹣,加入氢氧化钠后,抑制了亚硫酸根离子的水解,c(SO32﹣)与c(Na+)均增大. |
| 解答: | 解:A、等体积等浓度的HCN溶液和氢氧化钠溶液混合后,反应生成强碱弱酸盐NaCN,溶液显示碱性,一定满足c(Na+)>c(CN﹣),所以a mol/L的HCN溶液与b mol/L的NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN﹣),则a≤b,故A错误; B、CH3COONa溶液中,一定满足c(Na+)+c(H+)=c(CH3COO﹣)+c(OH﹣),溶液的pH=8,则c(H+)=1×10﹣8、mol/L、c(OH﹣)=1×10﹣6mol/L,所以c(Na+)﹣c(CH3COO﹣)=c(OH﹣)﹣c(H+)=1×10﹣6mol/L﹣1×10﹣8mol/L=9.9×10﹣7mol/L,故B正确; C、常温下,0.1mol/L的某酸溶液中,若c(OH﹣)/c(H+)=1×10﹣8,根据水的离子积可知:c(H+)=1×10﹣3mol/L;酸溶液中的氢氧根离子是水电离的,所以该溶液中由水电离出的c(H+)=1×10﹣11mol/L,故C正确; D、亚硫酸根离子存在水解平衡:SO32﹣+H2O⇌HSO3﹣+OH﹣,在0.1mol/L的Na2SO3溶液中加入少量NaOH固体,平衡向着逆向移动,亚硫酸根离子水解程度减小,溶液中c(SO32﹣)与c(Na+)均增大,故D正确; 故选A. |
| 点评: | 本题考查了酸碱混合时定性判断及有关pH的简单计算、盐的水解原理,题目难度中等,注意掌握判断酸碱混合后溶液酸碱性的方法及溶液pH的计算方法,明确盐的水解原理及其应用,能够利用电荷守恒、物料守恒比较或判断溶液中离子浓度. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)= H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.1/2H2SO4(aq)+1/2Ba(OH)2(aq)=1/2BaSO4(s)+H2O(l)ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
我国制碱工业的先驱——侯德榜先生,1939年发明了著名的侯氏制碱法,其核心反应原理可用如下化学方程式表示:NH3+C02+NaCl+H20→NH4CI+NaHCO3(晶体),依据此原理,欲制得碳酸氢钠晶体,某校学生设计了如下实验装置,其中B装置中的试管内是溶有氨和氯化钠的溶液,且二者均已达到饱和。
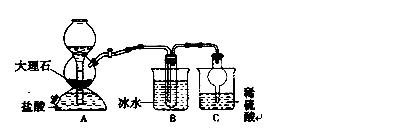
34.A装置中所发生反应的离子方程式为 C装置的作用为
35. 下表中所列出的是相关物质在不同温度下的溶解度数据(g/100 g水);
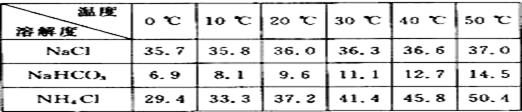
参照表中数据,请分析B装置中使用冰水的目的是 36.该校学生在检查完此套装置的气密性后进行实验,结果没有得到碳酸氢钠晶体,指导教师指出应在 装置之间(填写字母)连接一个盛有 的洗气装置,其作用 。 37.若该校学生进行实验时,所用饱和食盐水中含NaCl的质量为5.85 g,实验后得到干燥的NaHCO3晶体的质量为5.04 g,则NaHCO3的产率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于如图所示装置的叙述,正确的是( )

A. 铜是阳极,铜片上有气泡产生
B. 盐桥中的阳离子会移向CuSO4溶液
C. 正极附近的SO42﹣离子浓度逐渐增大
D. 锌离子在锌片表面被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
|
| A. | 碳酸氢钠的水解:HCO3﹣+H2O⇌H3O++CO32﹣ |
|
| B. | 以硫酸铝和小苏打为主要反应物的泡沫灭火器中的反应原理:Al3++3HCO3﹣═Al(OH)3↓+3CO2↑ |
|
| C. | 1 mol/L NH4Al(SO4)2溶液中逐滴加入等体积4 mol/L NaOH溶液:Al3++4OH﹣═AlO2﹣+2H2O |
|
| D. | 用惰性电极电解AlCl3溶液:2Cl﹣+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的稀溶液中不存在溶质分子
C.强电解质都是离子化合物,而弱电解质都是共价化合物
D.不同的弱电解质只要物质的量的浓度相同,电离程度也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| 化学式 | 电离常数 |
| HClO | K=3×10-8 mol·L-1 |
| H2CO3 | K1=4.3×10-7 mol·L-1 |
| K2=5.6×10-11 mol·L-1 |
A.[HCO ]>[ClO-]>[OH-]
]>[ClO-]>[OH-]
B.[ClO-]>[HCO ]>[H+]
]>[H+]
C.[HClO]+[ClO-]=[HCO ]+[H2CO3]
]+[H2CO3]
D.[Na+]+[H+]=[HCO ]+[ClO-]+[OH-]
]+[ClO-]+[OH-]
查看答案和解析>>
科目:高中化学 来源: 题型:
将1 mol Na和1 mol Al的混合物投入足量水中,产生气体在标准状况下的体积为( )
A.11.2 L B.22.4 L
C.33.6 L D.44.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
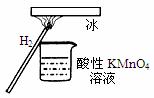
“暖冰”是韩国首尔大学科学家将水置于一个足够强的电 场中,在20℃时,水分子瞬间凝固形成的。某老师在课堂上做了一个如图所示的实验,发现烧杯中酸性KMnO4溶液褪色。若将烧杯中的溶液换成含有少量KSCN 的FeCl2溶液,则溶液呈血红色。则下列说法中不正确的是
A.在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰”
B.水凝固形成20℃时的“暖冰”所发生的变化是化学变化
C.该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D.该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com