
| A. | 无色气体可能是NO和CO2的混合物 | |
| B. | 原溶液可能存在Fe3+ | |
| C. | 溶液X中所含离子种类共有4种 | |
| D. | 另取l00mL原溶液X,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,理论上得到的固体质量为2.4g |
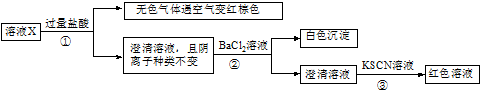
分析 溶液X加入过量盐酸生成无色气体,该气体与空气变红棕色,则可说明生成NO,X中一定含有NO3-和还原性离子,应为Fe2+,则溶液中一定不存在CO32-、OH-、SiO32-,都与Fe2+反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有Cl-,加入氯化钡生成白色沉淀,则一定含有SO42-,加入KSCN溶液呈红色,因Fe2+被氧化成Fe3+,则不能证明X中含有Fe3+,结合各离子物质的量浓度均为0.20mol•L-1解答该题.
解答 解:溶液X加入过量盐酸生成无色气体,该气体与空气变红棕色,则可说明生成NO,X中一定含有NO3-和还原性离子,应为Fe2+,则溶液中一定不存在CO32-、OH-、SiO32-,都与Fe2+反应生成沉淀,加入盐酸后阴离子种类不变,则说明X中含有Cl-,加入氯化钡生成白色沉淀,则一定含有SO42-,加入KSCN溶液呈红色,因Fe2+被氧化成Fe3+,则不能证明X中含有Fe3+,则溶液中一定存在的离子有Fe2+、Cl-、NO3-、SO42-,溶液中各离子物质的量浓度均为0.20mol•L-1,则还应含有K+、Mg2+、Fe3+、Al3+中的离子,结合电荷守恒可知,应含有Mg2+,则
A.无色气体只能为NO,故A错误;
B.由以上分析可知不含Fe3+,故B错误;
C.溶液X中所含离子有Fe2+、Cl-、NO3-、SO42-、Mg2+,共5种,故C错误;
D.另取100mL原溶液x,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,可得到0.01molFe2O3和0.02molMgO,二者质量恭维0.01mol×160g/mol+0.02mol×40g/mol=2.4g,故D正确.
故选D.
点评 本题考查物质的推断和离子的检验,侧重于学生的分析能力和计算能力的考查,注意根据离子的性质结合反应的现象解答该题,难度中等,易错点为B,注意结合电荷守恒解答该题.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| 反应前各物质的物质的量/mol | |||
| A | B | C | |
| 甲 | 6 | 2 | 0 |
| 乙 | 0 | 0 | 6 |
| 丙 | 6 | 2 | 6 |
| A. | 带大平衡时,丙中A的溶度是甲中的2倍 | |
| B. | 若反应开始时向容器中加入A为2mol,B为0.5mol,C为3mol,则反应v(正)>v(逆) | |
| C. | 到达平衡时,甲中A的转化率等于乙中C的转化率 | |
| D. | 若保持恒温恒压,达到平衡后再向乙容器中再充入2molC,C的百分含量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
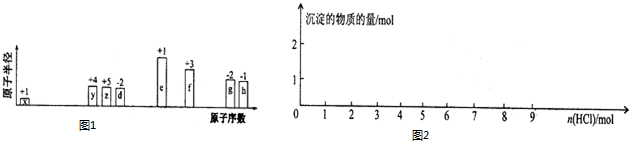
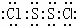 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
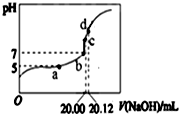 常温下,用20mL0.1000mol/L NaOH溶液滴定20mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )
常温下,用20mL0.1000mol/L NaOH溶液滴定20mL 0.1000mol/L CH3COOH溶液所得滴定曲线如图.下列说法不正确的是( )| A. | 滴定过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| B. | a点所示溶液中:c(Na+)=c(CH3COOH)+c(CH3COO-) | |
| C. | d点所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | b和c点所示溶液中:c(OH-)-c(H+)=c(Na+)-c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B、C、D的离子半径大小比较:C>D>B | |
| B. | 元素E的最高价氧化物对应水化物的酸性比D的强 | |
| C. | 元素B分别与A、C形成的化合物中化学键的类型完全相同 | |
| D. | 均含A、B、C、D四种元素的化合物X和Y在溶液中可发生氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 开始滴加氨水后溶液导电能力逐渐增强,说明HR为弱酸 | |
| B. | 滴入10mL氨水后酸碱恰好中和,此时溶液pH=7 | |
| C. | 随若氨水的加入,当c(OH-)>c(H+)时,c(NH4+)>(R-) | |
| D. | 该过程中溶液均有c(H+)•c(OH-)=KW=1.0×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.
碱式碳酸铜[2CuCO3•Cu(OH)2]可用于制造烟火等.在较低温度下,将Cu(NO3)2饱和溶液倒入一定浓度的Na2CO3溶液中,即有碱式碳酸铜生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤①②中的SO2气体和CO2气体可以用澄清石灰水溶液鉴别 | |
| B. | 步骤③中,检验FeCl3(aq)溶液中是否存有Fe2+,应该选用KSCN溶液 | |
| C. | 三个步骤中都没有氧化还原反应 | |
| D. | 常温下,H2SO3溶液中通入少量氯气,溶液pH减小,Kw不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com