
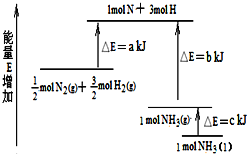
| A、N2(g)+3H2(g)?2NH3(l)△H=2(a-b-c)kJ/mol |
| B、N2(g)+3H2(g)?2NH3(g)△H=2(b-a)kJ/mol |
| C、0.5N2(g)+1.5H2(g)?NH3(l)△H=(b+c-a)kJ/mol |
| D、0.5N2(g)+1.5H2(g)?NH3(g)△H=(a+b)kJ/mol |
| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |


科目:高中化学 来源: 题型:
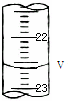 某实验中,用0.1000mol?L-1标准盐酸测定某NaOH溶液的浓度,其操作步骤如下:
某实验中,用0.1000mol?L-1标准盐酸测定某NaOH溶液的浓度,其操作步骤如下:| 序号 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数V1(mL) | 滴定后读数V2(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
| 第三次 | 20.00 | 5.15 | 30.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 品名 | 浓缩菠萝汁 |
| 配料 | 水、浓缩菠萝汁、蔗糖、柠檬酸、甜蜜素、维生素C、菠萝香精、柠檬黄、日落黄、山梨酸钾等 |
| 果汁含量 | ≥80%生产日期标于包装袋封口上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作、现象 | 实验结论 |
| A | 向某溶液中加入Ba(NO3)2溶液,生成白色沉淀,再加入稀盐酸沉淀不消失 | 该溶液中含有SO42- |
| B | 用铂丝蘸取某溶液进行焰色反应, 火焰呈黄色 | 该溶液中一定含有Na+, |
| C | 将硫酸酸化的H2O2滴入Fe(NO3)2溶液,溶液变为黄色 | H2O2的氧化性比Fe3+强 |
| D | 向溶液中加入新制氯水,再加几滴KSCN溶液溶液变红 | 该溶液中一定含有Fe2+ |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
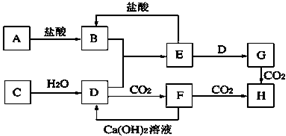 如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中C均为金属单质,H的焰色反应呈黄色,在通常状况下E跟NaOH或盐酸均可以发生反应.(反应过程中生成的水及其他产物已略去)请回答以下问题.
如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中C均为金属单质,H的焰色反应呈黄色,在通常状况下E跟NaOH或盐酸均可以发生反应.(反应过程中生成的水及其他产物已略去)请回答以下问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配置一定物质的量浓度的溶液时,先定容,后摇匀 |
| B、检查容量瓶是否漏水的方法是:往瓶中注水,倒转检查是否漏水即可 |
| C、用托盘天平称量 5.50g KCl |
| D、为保证测量准确,将被测物质放在天平上进行长时间的测量以保证数据准确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
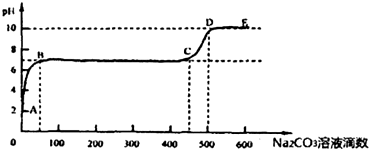
| A、天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子 |
| B、焊接时用NH4Cl溶液除锈与盐类水解无关 |
| C、生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理 |
| D、在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com