
现有A、B、C、D、E五种化合物,已知它们的阳离子有Al3+、Fe2+、K+、Ba2+、Ag+,阴离子有SO42-、Cl-、CO32-、NO3-、OH-现将它们分别配成0.1mol/L的溶液进行如下实验:
①测得C和E溶液显碱性,且碱性E>C
②A与C溶液混合后有白色沉淀和无色无味的气体生成,继续加入E溶液后溶液变澄清
③A溶液中加入D溶液后也出现白色沉淀,该沉淀不溶于稀硝酸
④B溶液中加入E溶液出现白色沉淀,沉淀迅速变成灰绿色,最后变成红褐色
根据以上实验,回答下列问题:
(1) 写出五种物质的化学式
A , B , C , D , E 。
(2)按要求写出下列反应的反应方程式:
A与C 反应的离子方程式: 。
A中加入过量的E溶液后的离子方程式 。
B与E反应后的白色沉淀在空气中最终变成红褐色的化学方程式: 。
(1)AlCl3、FeSO4、K2CO3、AgNO3、Ba(OH)2
(2)2Al3++3 CO32-+3 H2O= 3CO2↑+ 2Al(OH)3↓;Al3++4 OH-= AlO2-+2 H2O;
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
【解析】
试题分析:分析题意:由①得E为强碱Ba(OH)2、C为水解显碱性的盐,只能是K2CO3;由②得无色无味的气体是二氧化碳,则A为铝盐;由③得该沉淀为氯化银或硫酸钡,E中含Ba2+,所以该沉淀只能是氯化银,则D是AgNO3;由此推出A是AlCl3;剩余B只能是FeSO4。
(1)五种物质的化学式分别是AlCl3、FeSO4、K2CO3、AgNO3、Ba(OH)2
(2)A与C发生双水解反应,离子方程式为2Al3++3 CO32-+3 H2O= 3CO2↑+ 2Al(OH)3↓;AlCl3与过量Ba(OH)2反应生成偏铝酸钡和水,离子方程式为Al3++4 OH-= AlO2-+2 H2O;B与E反应后的白色沉淀是氢氧化亚铁沉淀,在空气中被氧气氧化生成氢氧化铁,化学方程式为4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
考点:考查根据实验现象判断物质组成,化学方程式、离子方程式的书写


科目:高中化学 来源:2013-2014宁夏高二下学期期末考试化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.离子晶体中可能含有共价键,一定含有金属元素
B.分子晶体中可能不含共价键
C.非极性分子中一定存在非极性键
D.对于组成和结构相似的分子晶体,一定是相对分子质量越大,熔沸点越高
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
下列关于 的说法中正确的是( )
的说法中正确的是( )
A. 原子核内有2个中子 B.
原子核内有2个中子 B. 原子核外有3个电子
原子核外有3个电子
C. 原子核内有3个质子 D.
原子核内有3个质子 D. 和
和 是两种不同的核素
是两种不同的核素
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省东北三省高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
下图是某企业设计的硫酸—磷肥—水泥联产、海水—淡水多用、盐—热—电联产的三大生态产业链流程图。

根据上述产业流程回答下列问题:
(1)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:① 、② 、③ 、④ 、⑤ 。
(2)沸腾炉发生反应的化学方程式: 。磷肥厂的主要产品是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙得化学方程式 。
(3)用1吨硫铁矿(FeS2的质量分数为36%)接触法制硫酸,制硫酸的产率为65%,则最后能生产出质量分数为98%的硫酸 吨。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据现代化工厂设计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。
, (写出两点即可)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省东北三省高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
下列化学用语表述正确的是
A.CH3COONH4的电离方程式为: CH3COONH4 CH3COO?+NH4+
CH3COO?+NH4+
B.NaHS的水解方程式为: HS?+H2O S2?+H3O+
S2?+H3O+
C.用过量的氨水吸收SO2的离子方程式为: 2NH3·H2O + SO2 =2NH4+ + SO32?+H2O
D.过量Fe粉与Cl2反应的化学方程式为: Fe +Cl2 FeCl2
FeCl2
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
如图所示,夹子开始处于关闭状态,将液体A滴入烧瓶与气体B充分反应,打开夹子,可发现试管内的水立刻沸腾了,则液体A和气体B的组合不可能是( )
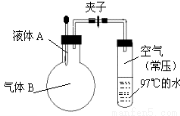
A.水、氯化氢
B.硫酸、氨气
C.氢氧化钠溶液、二氧化硫
D.氢氧化钠溶液、一氧化碳
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
NA代表阿伏加德罗常数的数值,下列叙述正确的是( )
A.在H2O2+Cl2=2HCl+O2反应中,每生成32 g氧气,转移4NA个电子
B.常温常压下,33.6 L Cl2与56 g Fe充分反应,转移电子数为3NA
C.标准状况下分子数为NA的CO、C2H4混合气体体积约为22.4 L,质量为28 g
D.在1 L 0.2 mol·L-1的硫酸铁溶液中含有的铁离子数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省张掖市高三第三次诊断考试理综化学试卷(解析版) 题型:选择题
人类使用铜和它的合金具有悠久的历史,铜及其化合物在电子工业、材料工业、工农业生产及日常生活方面用途非常广泛。试回答下列问题。
(1)Cu+的核外电子排布式为 。
(2)铜镁合金是一种储氢材料,某种铜镁互化物晶胞结构如图,则该互化物的化学式为 。

(3)叠氮化铜[Cu(N3)2]是一种紫黑色粉末,易爆炸,与N3-互为等电子体的分子有 (举2例)。
(4)丁炔铜是一种优良的催化剂,已知:CH≡CH+2HCHO OHC-CH2CH2OH。
OHC-CH2CH2OH。
OHC-CH2CH2OH中碳原子杂化方式有 ,乙炔属于 (填“极性”或“非极性”)分子。
(5)若向盛有CuSO4溶液的试管里加入氨水,首先形成蓝色难溶物,继续加入氨水,难溶物溶解,变成蓝色透明溶液,这时得到一种称为硫酸四氨合铜的物质,该物质的化学式为______________,其中含有的化学键类型有 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖北省天门市毕业生四月调研测试理综化学试卷(解析版) 题型:填空题
Ⅰ.在一定条件下,科学家利用从烟道气中分离出CO2与太阳能电池电解水产生的H2合成甲醇,其过程如下图所示,试回答下列问题:

(1)该合成路线对于环境保护的价值在于 。
(2)15~20%的乙醇胺(HOCH2CH2NH2)水溶液具有弱碱性,上述合成线路中用作CO2吸收剂。用离子方程式表示乙醇胺水溶液呈弱碱性的原因 。
(3)CH3OH、H2的燃烧热分别为:△H=-725.5 kJ/mol、△H=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
Ⅱ.将燃煤废气中的CO2转化为甲醚的反应原理为:
2CO2(g) + 6H2(g)  CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% | 15% |
3.0 | 83% | 62% | 37% | 22% |
(4)该反应的焓变△H 0,熵变△S 0(填>、<或=)。
(5)用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
(6)若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com