
(17分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
回答下列问题:
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加NH3物质的量 |
 2NH3(g) +
2NH3(g) +  O2(g) ;△H =" a" kJ·mol—1
O2(g) ;△H =" a" kJ·mol—1| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1(17分)(1)v = 0.005 mol·L-1 ·min-1 ;(1分) (2)AB(1分)
(3)20~25 min (1分) 35~40 min (1分)
K =(0.15)2 0.125×(0.075)3 (带数据的表达式),(1分) 45.5 % ;(1分)
(4)①移走0.1 mol NH3,(2分)②等于(1分)
(5)△H= —2.31 KJ·mol-1。(2分) (6) ①>、> (各1分)
②2N2(g) + 6H2O(1) = 4NH3(g) + 3O2(g) ΔH="+1530" kJ·mol-1 (2分)或
N2(g) + 3H2O(1) = 2NH3(g) +  O2(g) ΔH="+765" kJ·mol-1 (2分)
O2(g) ΔH="+765" kJ·mol-1 (2分)
解析


 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案科目:高中化学 来源: 题型:
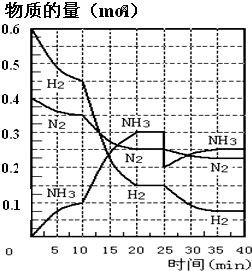 氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ?mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:
氨的合成原理为:N2(g)+3H2(g)?2NH3(g);△H=-92.4KJ?mol-1.现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图.回答下列问题:| c(NH3)2 |
| c(N2).c(H2)3 |
| c(NH3)2 |
| c(N2).c(H2)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
(27分)氨的合成原理为:N2(g)+3H2(g)![]() 2NH3(g) ;△H=—92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H=—92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:

(1)10min内以NH3表示的平均反应速率 ;
(2)在10~20 min内:NH3浓度变化的原因可能是 ;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为: ,
第2次平衡的时间范围为: ,
第1次平衡:平衡常数K1 = (带数据的表达式),
第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:
① 曲线发生变化的原因:
② 达第二次平衡时,新平衡的平衡常数
K2 K1(填“大于”、“等于”、“小于”);
(5)在25~40min时,计算合成氨过程中的反应热△H= 。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g)+ 3H2O(1) ![]() 2NH3(g)+
2NH3(g)+ ![]() O2(g) ;△H = a kJ·mol—1
O2(g) ;△H = a kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表:
| T/K | 303 | 313 | 323 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的a 0;ΔS 0,(填“>”、“<”或“=”)
②已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH= -92 .4kJ·mol—1
2NH3(g) ΔH= -92 .4kJ·mol—1
2H2(g)+ O2(g) = 2H2O(l)= -571.6kJ·mol—1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省赣州市十一县(市)高二上学期期中联考化学试卷(带解析) 题型:填空题
氨的合成原理为:N2(g)+3H2(g) 2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题:
2NH3(g) ;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如右图。回答下列问题: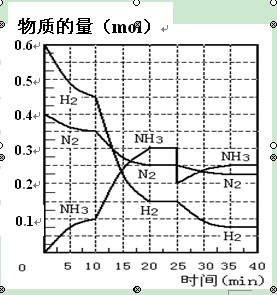
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
| A.加了催化剂 | B.缩小容器体积 | C.降低温度 | D.增加NH3物质的量 |
查看答案和解析>>
科目:高中化学 来源:2014届福建省高二第二次月考化学试卷(解析版) 题型:填空题
(16分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g)
;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g)
;△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
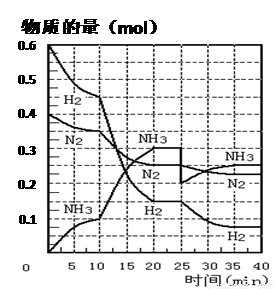
(1)10 min内以NH3表示的平均反应速率 ;
(2)在10 ~20 min内:NH3浓度变化的原因可能是 ;
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加NH3物质的量
(3)第1次平衡的时间范围为: ,第2次平衡的时间范围为: ,第1次平衡:平衡常数K1 = (带数据的表达式),第2次平衡时NH3的体积分数 ;
(4)在反应进行至25 min时:① 曲线发生变化的原因: ② 达第二次平衡时,新平衡的平衡常数K2 K1(填“大于”、“等于”、“小于”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com