
【题目】在一密闭容积的容器中进行反应:2SO2(g)+O2(g) ![]() 2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 molL-1、0.1 molL-1、0.2 molL-1。当反应达平衡时,可能存在的数据是
A. SO2为0.4 molL-1,O2为0.2 molL-1 B. SO2为0.25 molL-1
C. SO2、SO3均为0.15 molL-1 D. SO3为0.4 molL-1
【答案】B
【解析】
可逆反应达到平衡时,物质都不能完全反应,反应物、生成物一定共存。
A、SO2和O2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2和O2的浓度变为0.4mol/L、0.2mol/L,实际变化应小于该值,故A错误; B、SO2的浓度增大,说明反应向逆反应方向进行建立平衡,若SO3完全反应,则SO2的浓度浓度变化量为0.2mol/L,实际变化为0.05mol/L,小于0.2mol/L,故B正确; C、反应物、生成物的浓度不可能同时减小,一个减小,另一个一定增大,故C错误; D、SO3的浓度增大,说明该反应向正反应方向进行建立平衡,若二氧化硫和氧气完全反应,SO3的浓度的浓度变为0.4mol/L,实际变化应小于该值,故D错误.


科目:高中化学 来源: 题型:
【题目】一定量的甲烷在O2不足的情况下燃烧,得到CO、CO2和H2O的总质量为14.4 g,若其中水的质量为7.2 g,则CO的质量是 ( )。
A. 2.8 gB. 4.4 gC. 5.6 gD. 在2.8 g~5.6 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中,不属于氮的固定的是( )
A. 闪电时,N2变为NO B. NO被空气中O2氧化为NO2
C. 工业上,用N2合成氨 D. 豆科植物根瘤菌把N2变成NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常教的值,N表示粒子数。下列叙述正确的是
A. 在标准状况下,78g苯的碳碳双键数目为3NA
B. 将1molCl2通入水中,则N(HClO)+N(C1-)+N(C1O-)=2NA
C. 将CO2通过Na2O2使其增重ag时,反应中转移电子数为aNA/44
D. 200g 30%的甲醛(HCHO)或醋酸溶液中含有的C原子总数都为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO和H2的混合气体称为水煤气,可由碳与水蒸气在高温下反应生成。如下图:
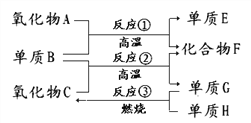
已知:单质E可作为半导体材料,化合物F是有毒的氧化物,C常温下为液态。据此,请填空:(用化学式回答)
(1)氧化物A是_____________
(2)化合物F是___________
(3)反应②的化学方程式是_____________________________________
(4)反应③的化学方程式是_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合金用途广泛,如新型储氢合金材料的研究和开发,将为氢气作为能源的实际应用起到重要的推动作用。下列材料中,不属于合金的是
A. 青铜 B. 黄铜
C. 陶瓷 D. 不锈钢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁在生产生活中应用最广泛,炼铁技术和含铁新材料的应用倍受关注。
(1)高炉炼铁是冶炼铁的主要方法,发生的主要反应有:
反应 | △H(kJ/mol) | K |
i. Fe2O3(s)+3C(s) | +489 | K1 |
ii. Fe2O3(s)+3CO(g) | X | K2 |
iii. C(s)+CO2(g) | +172 | K3 |
试计算,X=_____,K1、K2与K3之间的关系为K1=__________。
(2)T1℃时,向某恒温密闭容器中加入一定量的Fe2O3和C,发生反应i,反应达到平衡后,在t1时刻,改变某条件,V(逆)随时间(t)的变化关系如图1所示,则t1时刻改变的条件可能是_____(填写字母)。
a.保持温度不变,压缩容器 b.保持体积不变,升高温度
c.保持体积不变,加少量碳粉 d.保持体积不变,增大CO浓度
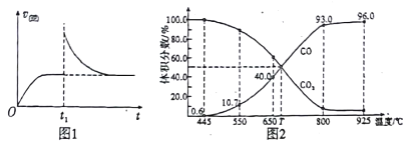
(3)在一定温度下,向某体积可变的恒压密闭容器(p总)加入1molCO2 与足量的碳,发生反应ⅲ,平衡时体系中气体体积分数与温度的关系如图2 所示。
①650℃时,该反应达平衡后吸收的热量是_________。
②T℃时,若向平衡体系中再充入一定量按V(CO2):V(CO) =5:4的混合气体,平衡_____(填“ 正向”、“ 逆向”或“ 不” )移动。
③925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp为_____。[气体分压(p分)=气体总压(p总) ×体积分数,用某物质的平衡分压代替物质的量浓度也可以表示化学平衡常数,记作Kp]
(4)用原电池原理可以除去酸性废水中的三氯乙烯、AsO3-,其原理如下图所示( 导电壳内部为纳米零价铁)。
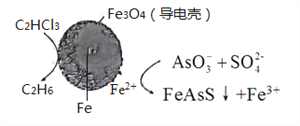
在除污过程中,纳米零价铁中的Fe为原电池的______极 (填“正"或“负”),写出C2HCl3在其表面被还原为乙烷的电极反应式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com