
分析 (1)碳与浓硝酸生成二氧化碳、二氧化氮和水;
(2)浓硝酸的分解,产生氧气和红棕色气体二氧化氮,据此书写方程式可得;
(3)①木炭在氧气中燃烧只有红热现象;
②根据(2)可知浓硝酸分解产生氧气与二氧化氮为1:4,与空气类似,与甲猜想相似;
③丙猜想认为反应产生的NO2支持木炭燃烧,故按照该想法可以将碳在纯净的NO2中燃烧,应该生成二氧化碳气体,检验二氧化碳即可.
解答 解:(1)碳与浓硝酸生成二氧化碳、二氧化氮和水,反应方程式为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
故答案为:C+4HNO3(浓) $\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
(2)浓硝酸的分解,产生氧气和红棕色气体二氧化氮,反应为:4HNO3=O2↑+4NO2↑+2H2O,故该分解反应产生的氧气与红棕色气体的体积之比为1:4;
故答案为:1:4;
(3)①木炭在液面上迅速燃烧发出光亮,甲猜想为空气中O2支持木炭燃烧,木炭在空气中燃烧,只产生红热现象,故该猜想不合理;
故答案为:木炭在空气中燃烧,只产生红热现象;
②根据(2)可知浓硝酸分解产生O2和NO2为1:4,按照二者比例,产生的氧气浓度与空气相近,故也应只产生红色现象,乙猜想不合理;
故答案为:浓硝酸分解产生O2和NO2为1:4,按照二者比例,产生的氧气浓度与空气相近;
③丙猜想认为反应产生的NO2支持木炭燃烧,故按照该想法可以将碳在纯净的NO2中燃烧,应该生成二氧化碳气体,用澄清石灰水检验二氧化碳即可,具体方法为:在收集满NO2的试管中伸进一块带火星的木炭,若木炭立即复燃,反应完成后,加入少量澄清石灰水振荡,产生白色沉淀(浑浊),说明起助燃作用的气体是NO2;
故答案为:在收集满NO2的试管中伸进一块带火星的木炭,若木炭立即复燃,反应完成后,加入少量澄清石灰水振荡,产生白色沉淀(浑浊),说明起助燃作用的气体是NO2.
点评 本题主要考查学生分析实验和书写化学方程式的能力,尤其是对实验原理的分析要求较高,要求学生有较高的逻辑推理能力和扎实的实验基本功能,注意知识的归纳和梳理是解题的关键,难度较大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 13g乙炔中含有共用电子对的数目为1.5NA | |
| B. | 含有2NA个氧原子的氧气和臭氧的混合气体的质量为32g | |
| C. | 1 mol•L-1碳酸钠溶液中含有的碳酸根离子的数目小于NA | |
| D. | 标准状况下,将22.4LCl2通入水中发生反应,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
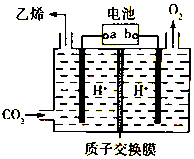
| A. | b为铅蓄电池的正极 | |
| B. | 电解过程中,阳极区溶液中c(H+)逐渐减小 | |
| C. | 阴极反应式:2CO2+12H++12e-═C2H4+4H2O | |
| D. | 每生成1mol乙烯,理论上铅蓄电池中消耗12mol硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料,又可作为燃料.工业上利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:| 化学键 | H-H | C-O | C≡O | H-O | C-H |
| E/(KJ•mol-1) | 436 | 343 | 1076 | 465 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若X,Y位于IA族,则化合物YX与水反应时水作还原剂 | |
| B. | 若X、Y位于第三周期,则X、Y形成的化合物只含离子键 | |
| C. | 若氢化物还原性HaX<HbY,则单质氧化性m>n | |
| D. | 若X、Y位于同一主族,则简单离子半径X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀H2SO4 | B. | 稀盐酸 | C. | K2SO4固体 | D. | KNO3固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )
已知某化学反应A2(g)+2B2(g)═2AB2(g)(A2、B2、AB2的结构式分别为 A═A、B-B、B-A-B),能量变化如图所示,下列有关叙述中正确的是( )| A. | 该反应的进行一定需要加热或点燃条件 | |
| B. | 该反应若生成2molAB2(g)则放出的热量为 (E1-E2) kJ | |
| C. | 该反应断开化学键消耗的总能量大于形成化学键释放的总能量 | |
| D. | 生成2 mol B-A键放出E2 kJ能量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com