
| A. | 铝片与盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl晶体的反应 | ||
| C. | NaOH与HCl反应 | D. | 食物的缓慢氧化 |
分析 根据常见的放热反应有:所有的物质燃烧、所有金属与酸反应、金属与水反应,所有中和反应;绝大多数化合反应和铝热反应;
常见的吸热反应有:绝大数分解反应,个别的化合反应(如C和CO2),少数分解置换以及某些复分解(如铵盐和强碱).
解答 解:A、铝片与盐酸反应属于金属与酸反应,为放热反应,故A错误;
B、Ba(OH)2•8H2O与NH4Cl晶体反应是吸热反应,故B正确;
C、NaOH与HCl反应为中和反应是放热反应,故C错误;
D、食物的缓慢氧化是氧化反应,是放热反应,故D错误;
故选B.
点评 本题考查吸热反应,抓住中学化学中常见的吸热或放热的反应是解题的关键,对于特殊过程中的热量变化的要熟练记忆来解答此类习题.


 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
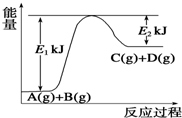 已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.
已知某反应A(g)+B(g)?C(g)+D(g),过程中的能量变化如图所示,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体的晶格能是气态离子形成1mol晶胞时放出的能量 | |
| B. | 金属的六方最密堆积和面心立方最密堆积的空间利用率最高 | |
| C. | 钠晶胞结构如图 ,钠晶胞中每个钠原子的配位数为8 ,钠晶胞中每个钠原子的配位数为8 | |
| D. | 温度升高,金属的导电性将变弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2CH2CH3 | C. | (CH3)2CHCH(CH3)2 | D. | CH3CH2CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
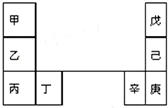 甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )
甲--辛等元素在周期表中的相对位置如图.甲和戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁和辛属同周期元素,下列判断正确的是( )| A. | 金属性:甲>乙>丁 | |
| B. | 原子半径:辛>己>戊 | |
| C. | 丙与庚的原子核外电子数相差14 | |
| D. | 乙的单质在空气中燃烧生成只含离子键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当c(Cu2+)=c(Mn2+)时该反应达到平衡 | |
| B. | 从该反应原理可以得出CuS的溶解度比MnS的溶解度大 | |
| C. | 该反应的平衡常数K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ | |
| D. | 往平衡体系中加入少量CuSO4(s)后,c( Mn2+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C、D、E、A、B | B. | E、C、D、A、B | C. | B、A、D、C、E | D. | B、A、E、D、C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com