
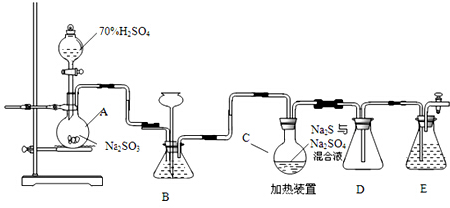
| ||
| ||
| ||
| ||
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、电解精炼铜时,若阳极质量减少6.4g,则电路中转移电子数为0.2NA |
| B、标准状况下,44.8L NO与22.4L O2混合后气体中分子总数等于2NA |
| C、1mol Fe在氧气中充分燃烧失去3NA个电子 |
| D、NO2和H2O反应每生成2mol HNO3时转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应A2(g)+3B2(g)═2AB3(g)在一定温度下能自发进行,则该反应的△H<0 |
| B、将NH3 通入热的CuSO4 溶液中能使Cu2+还原成Cu |
| C、钙和镁的氯化物溶液蒸发结晶出来的固体都是水合物,经焙烧得相应无水盐 |
| D、用酸溶解金属铝时,溶解的速率与铝的纯度有关,纯度越高速率越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
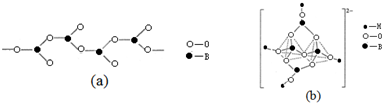
查看答案和解析>>
科目:高中化学 来源: 题型:
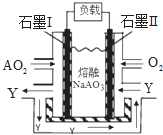 A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:| 元素 | A | B | C | D | E |
| 相关 信息 |
最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )
25℃时,由弱酸(HA)及其盐(NaA)组成的混合溶液,起始浓度均为1mol?L-1.如图为向该溶液中通入HCl气体或加入NaOH固体时,溶液pH随加入H+或OH-的物质的量而变化的曲线.下列说法中,正确的是( )| A、加NaOH,HA电离平衡常数增大 |
| B、通入HCl,溶液中阴离子浓度之和减小 |
| C、溶液中水的电离程度a>b>c |
| D、b点溶液中,c(HA)<c(A-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、22.4L氯气与足量氢氧化钠溶液反应转移的电子数为NA |
| B、常温下,1L O.1mol/L NH4NO3的溶液中含氮原子数为0.2NA |
| C、室温下,21.Og乙烯和丁烯的混合气体中含有的碳原子数目为NA |
| D、含NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为1mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com