
分析 先判断强弱电解质,强电解质完全电离,电离方程式用等号,弱电解质部分电离,电离方程式用可逆号,据此进行解答.
解答 解:NaHSO4为强电解质,在溶液中完全电离,其电离方程式为:NaHSO4═Na++H++SO42-;
K2SO4在溶液中完全电离出钾离子和硫酸根离子,其电离方程式为:K2SO4═2K++SO42-;
NH4NO3为强电解质,在溶液中完全电离出铵根离子和硝酸根离子,其电离方程式为:NH4NO3═NH4++NO3-;
KHCO3在溶液中完全电离,其电离方程式为:KHCO3═K++HCO3-,
故答案为:NaHSO4═Na++H++SO42-;K2SO4═2K++SO42-;NH4NO3═NH4++NO3-;KHCO3═K++HCO3-.
点评 本题考查了电离方程式的书写,题目难度不大,正确判断强弱电解质为解答关键,注意掌握电离方程式的书写原则,试题有利于培养学生的规范答题能力.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ①②④⑥ | C. | ①③⑤⑦ | D. | ①③⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对燃烧煤时产生的尾气进行除硫处理 | |
| B. | 往已经酸化的土壤撒石灰中和 | |
| C. | 煤燃烧时鼓入足量空气 | |
| D. | 将煤除硫后再燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H4=$\frac{2}{3}$ (3△H3-△H1)-△H2 | B. | △H4=$\frac{2}{3}$ (△H1+△H2)+△H3 | ||
| C. | △H4=$\frac{2}{3}$ (△H1+△H2)-△H3 | D. | △H4=$\frac{2}{3}$ (△H1-△H2)-△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

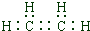 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.50 | 2.50 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| m | α | y |
| 1 | 0.25 | 16.67% |
| 2 | 0.45 | |
| 3 | 0.56 | 19.35% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过滤操作中,玻璃棒应适时搅拌漏斗器 | |
| B. | 蒸发时,不能把蒸发皿放置于石棉网上加热 | |
| C. | 萃取分液时,将塞上凹槽或小孔对准漏斗上小孔,然后打开活塞才能放出下层液体 | |
| D. | 配制容量瓶,定容时改用胶头滴管滴加蒸馏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com