
【题目】工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol. 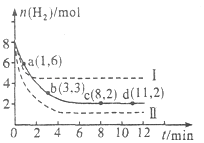
(1)a点正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(2)下列时间段平均反应速率最大的是 .
A.O~1min
B.1~3min
C.3~8min
D.8~11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线).曲线I对应的实验条件改变是 , 曲线Ⅱ对应的实验条件改变是 , 体积不变再充入3molCO2和4mol H2 , H2O(g)的体积分数(填“增大”“不变”或“减小”).
(4)若将1molCO2和3molH2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 .
【答案】
(1)大于
(2)A
(3)升高温度;增大压强;增大
(4)![]()
【解析】解:(1)a点时还没有达到平衡状态,反应物氢气的物质的量继续减小,平衡向正向移动,所以正反应速率大于逆反应速率,所以答案是:大于;(2)由图可知,
A.0~1min内氢气的变化量为8mol﹣6mol=2mol;
B.1~3min内氢气的变化量为6mol﹣3mol=3mol,平均1min变化量为1.5mol;
C.3~8min内氢气的变化量为3mol﹣2mol=1mol,平均1min变化量为0.2mol;
D.8~11min达平衡状态,氢气的物质的量不再变化.
故1~3min速率增大.
所以答案是:A;(3)曲线I反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动,不利于氢气的转化,故曲线I是升高温度;曲线Ⅲ反应速率增大,转化的氢气的物质的量多,因增大压强平衡正向移动,故应是增大压强,体积不变再充入3molCO2和4mol H2,相当于增大压强,平衡正向移动,则H2O(g)的体积分数增大,
所以答案是:升高温度;增大压强;增大;(4)在T1度时,将1molCO2和3molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为a,
CO2(g)+ | 3H2(g)= | CH2OH(g)+ | H2O(g) | |
起始(mol) | 1 | 3 | 0 | 0 |
转化(mol) | a | 3a | a | a |
平衡(mol) | 1-a | 3-3a | a | a |
容器内的压强与起始压强之比=(4﹣2a):4= ![]() ,
,
所以答案是: ![]() .
.
【考点精析】解答此题的关键在于理解化学平衡的计算的相关知识,掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.


科目:高中化学 来源: 题型:
【题目】瑞典化学家舍勒将软锰矿(主要成分为MnO2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用如图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
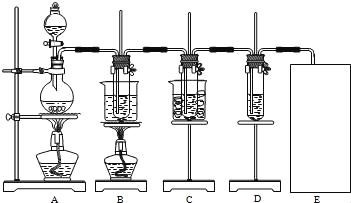
图中:A为氯气发生装置;B的试管里盛有15mL 30% KOH溶液,并置于水浴中;C的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;D的试管里盛有紫色石蕊试液.
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过_____(填仪器名称)向圆底烧瓶中加入适量的浓盐酸.装置A中反应的离子方程式是_____.
(2)制取氯酸钾是在装置B中进行的,装置B中制取氯酸钾的化学反应方程式是____________.该小组同学发现制得的氯酸钾产量偏低,原因是氯气中含有杂质,改进方法是______.
(3)实验中装置D的试管中产生的现象是________.
(4)请在装置图方框中画出上述实验还缺少的装置,并注明试剂.________
(5)该小组同学认为:SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强.但是如果将SO2和Cl2同时通入到品红溶液中,则会发现褪色效果并不像该小组同学想象的那样.请你分析原因(用离子方程式表示)_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水提镁的主要流程如下,下列说法正确的是

①试剂M是盐酸 ②流程中的反应全部都是非氧化还原反应
③操作b只是过滤 ④用海水晒盐后的饱和溶液加石灰乳制Mg(OH)2
⑤采用电解法冶炼镁是因为镁很活泼
A. ①②③④⑤ B. ②③ C. ④⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),②位于元素周期表的第____纵行。
(2)这些元素的最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大的顺序为___________________(用序号表示)。
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同 B.③的简单氢化物比⑥的简单氢化物稳定
C.简单氢化物的沸点:③>⑥ D.③的单质能与⑥的简单氢化物反应生成⑥的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿托酸是一种常用的医药中间体,合成路线如下:

(1)①的反应类型是_________;②的反应试剂和条件是________________。
(2)反应③是氧化反应,但有一个羟基没有被氧化。原因是___________________;
欲检验反应④的有机产物,可选择的试剂是________________________。
a. Na b. NaCl溶液 c. NaOH溶液 d. NaHCO3溶液
(3)写出反应⑤的化学方程式__________________________________;写出一种与阿托酸具有相同官能团的同分异构体的结构简式__________________。
(4)由CH2=CH-CHO和乙醇可以合成CH3CH2COOC2H5。写出其合成路线。____________
(合成路线常用的表示方式为:X![]() Y……
Y……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是大气污染物的主要成分。防止空气污染,保卫“兰州蓝”是兰州市一项重要民生工程。利用下图所示装置(电极均为惰性电极)可以吸收SO2还可以用阴极排出的溶液吸收NO2。下列说法错误的是
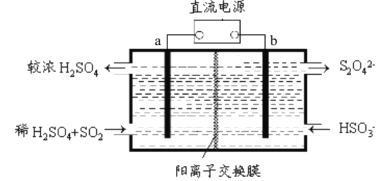
A. 电极a应连接电源的正极
B. 电极b上的电极反应式为2HSO3-+2e-+2H+=S2O42-+2H2O
C. 反应过程中,H+从a极室流向b极室
D. 每吸收标况下22.4LSO2,在b极室生成2NA个S2O42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.所有主族中都存在非金属元素
B.同周期元素中,第ⅦA族元素的原子半径最大
C.第ⅥA族元素的原子半径越大,越容易得到电子
D.元素周期表中第ⅢB族到第ⅡB族10个纵列的元素都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.2Al+Fe2O3![]() Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:
Al2O3+2Fe在化学反应过程中产生超高热,曾用于钢轨焊接。完成下列填空:
(1)氧元素在元素周期表中的位置为_______________,其离子结构示意图为__________。
(2)铝盐常用作净水剂,用文字和化学用语进行解释_______________________________。
(3)氧的非金属性强于氮,用元素周期律知识分析原因_____________________________。
(4)Al2O3与NaOH溶液反应的离子方程式为______________________________________。
II.NH4Al(SO4)2·12H2O水溶液呈_____性(选填“酸”、“碱”或“中”),比较溶液中离子浓度大小c(NH4+)_____c(Al3+)(选填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com